无涯创新学院罗聪课题组在多模式驱动前药激活和协同抗血栓领域取得新进展
作者:
日期:2025-01-03
浏览次数:
在全球范围内,血栓性疾病的发病率与死亡率呈现出不断攀升的严峻态势,已然对人类的健康构成了重大的威胁。在临床实践中,尽管溶栓药、抗凝药以及抗血小板药被广泛应用,但抗血栓药物就像是一把双刃剑,在发挥治疗作用的同时,也因抗血栓机制与体内凝血通路有关联,导致出血风险大,难以通过提升剂量实现更加强效的抗血栓效果。鉴于此,前药策略因其暂时屏蔽药物活性这一独特优势而备受瞩目,有望显著降低出血风险。研究表明,血栓微环境具有一个显著的特征,即活性氧(ROS)的水平出现异常的升高现象。故而,血栓内ROS水平的升高这一特性被巧妙地用于设计氧化响应型前药。然而,血栓病灶内ROS水平分布具有高度的异质性,且高浓度的ROS往往处于接近受损血管内皮细胞的栓块深部,这使得ROS响应型前药的临床应用面临着巨大挑战。因此,单纯依赖内源性ROS激活氧化响应前药的策略具有很大的局限性。

近日,沈阳药科大学无涯创新学院罗聪教授团队在《ACS Nano》(IF=15.8)在线发表了最新研究成果“On-Site Self-Penetrating Nanomedicine Enabling Dual-Priming Drug Activation and Inside-Out Thrombus Ablation”。该研究提出了一种基于光热/光动双效光敏剂与氧化响应抗血小板前药共组装实现多模式激活抗血栓前药的新策略,有望解决血栓ROS异质性导致的前药激活瓶颈难题。在该研究中,作者首先设计合成了一种抗血小板药物替格瑞洛(TGL)的氧化响应前药(TGL-S-Fmoc, TSF)。随后,发现TSF可以与光热/光动双功能的光敏剂IR808共组装形成稳定的纳米结构。基于此,作者开发了一种自穿透、自激活、多模式协同的无载体纳米组装递药系统(T-TSFI NAs)。在光热效应的辅助下,T-TSFI NAs不仅能够实现血栓的深部穿透,还通过产生ROS协同内源性ROS触发前药按需激活,栓块内部释放抗血小板药物TGL,从而实现光热/抗血小板协同溶栓。T-TSFI NAs在FeCl₃诱导的大鼠颈动脉血栓模型中不仅有效抑制了血小板的激活和聚集,还显著降低了出血风险。这一策略成功克服了血栓微环境中ROS分布不均的难题,为抗血栓前药按需高效激活提供了新思路。
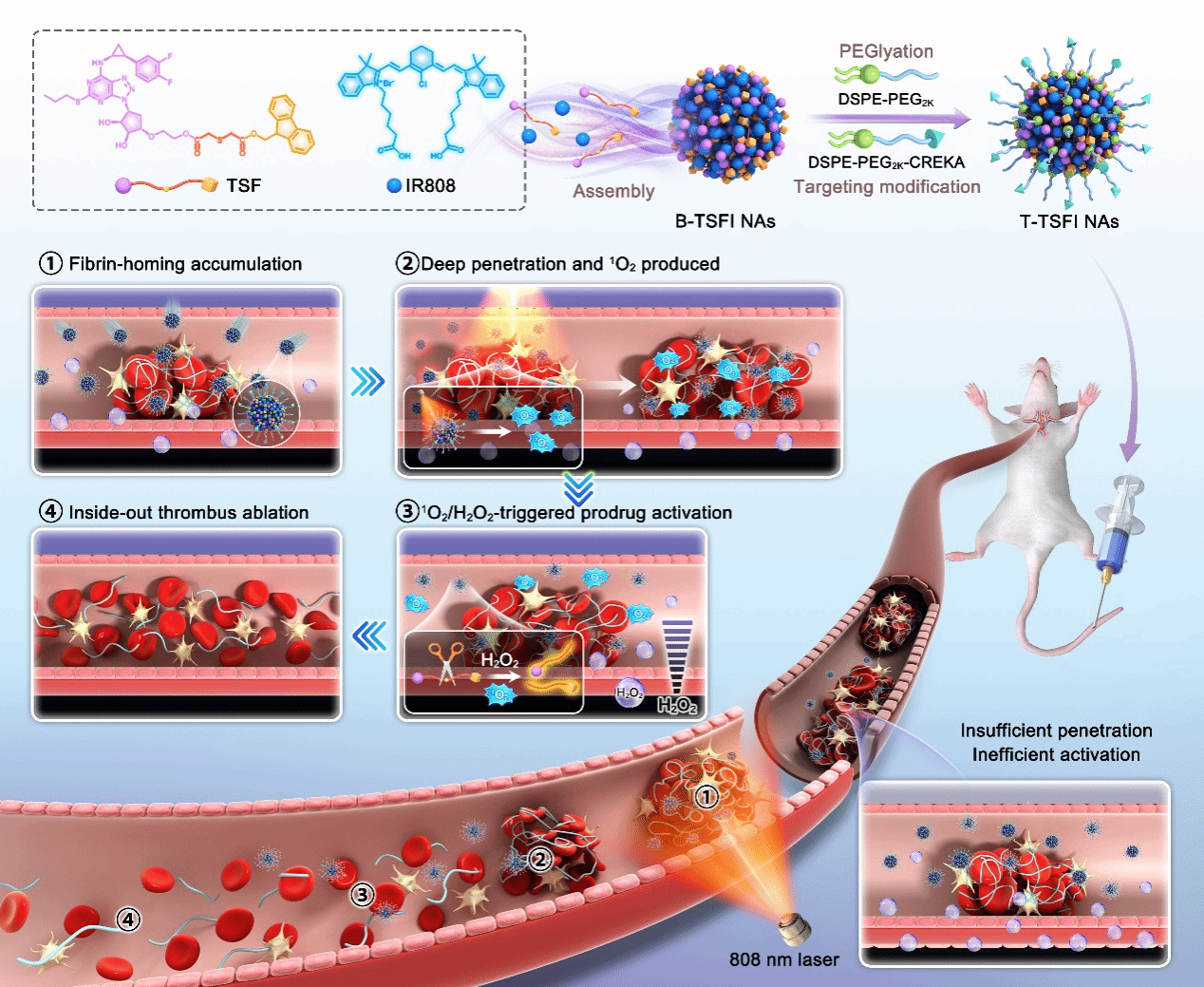
图1.自激活型前药杂化纳米组装体用于实现按需药物激活和协同溶栓的示意图
本文旨在利用氧化敏感键(单硫键)桥链抗血小板药物TGL和9-芴甲醇(9-Fluorenyl-methanol, Fmoc)形成前药(TGL-S-Fmoc, TSF),其中Fmoc作为修饰基团可增加TGL的疏水性增强药物组装性能。为了进一步实现纳米前药的深部渗透和高效激活,将兼具光热、光动双功能的光敏剂1-(5-羧基戊基)-2-(2-(3-(2-(1-(5-羧基戊基)-3,3-二甲基吲哚啉-2-亚基)亚乙基)-2-氯环己基-1-烯-1-基)乙烯基)-3,3-二甲基-3H-吲哚-1-鎓溴化物(IR808)与前药进行共组装,经少量的聚乙二醇(DSPE-PEG2K)和纤维蛋白靶向肽修饰的聚乙二醇(DSPE-PEG2K-CREKA)共同修饰后制成无载体前药纳米组装体(T-TSFI NAs),该纳米组装体展现出良好的制剂学性质,可以实现两种药物的高效共载和同步递送,具有良好的稳定性。(如图2所示)
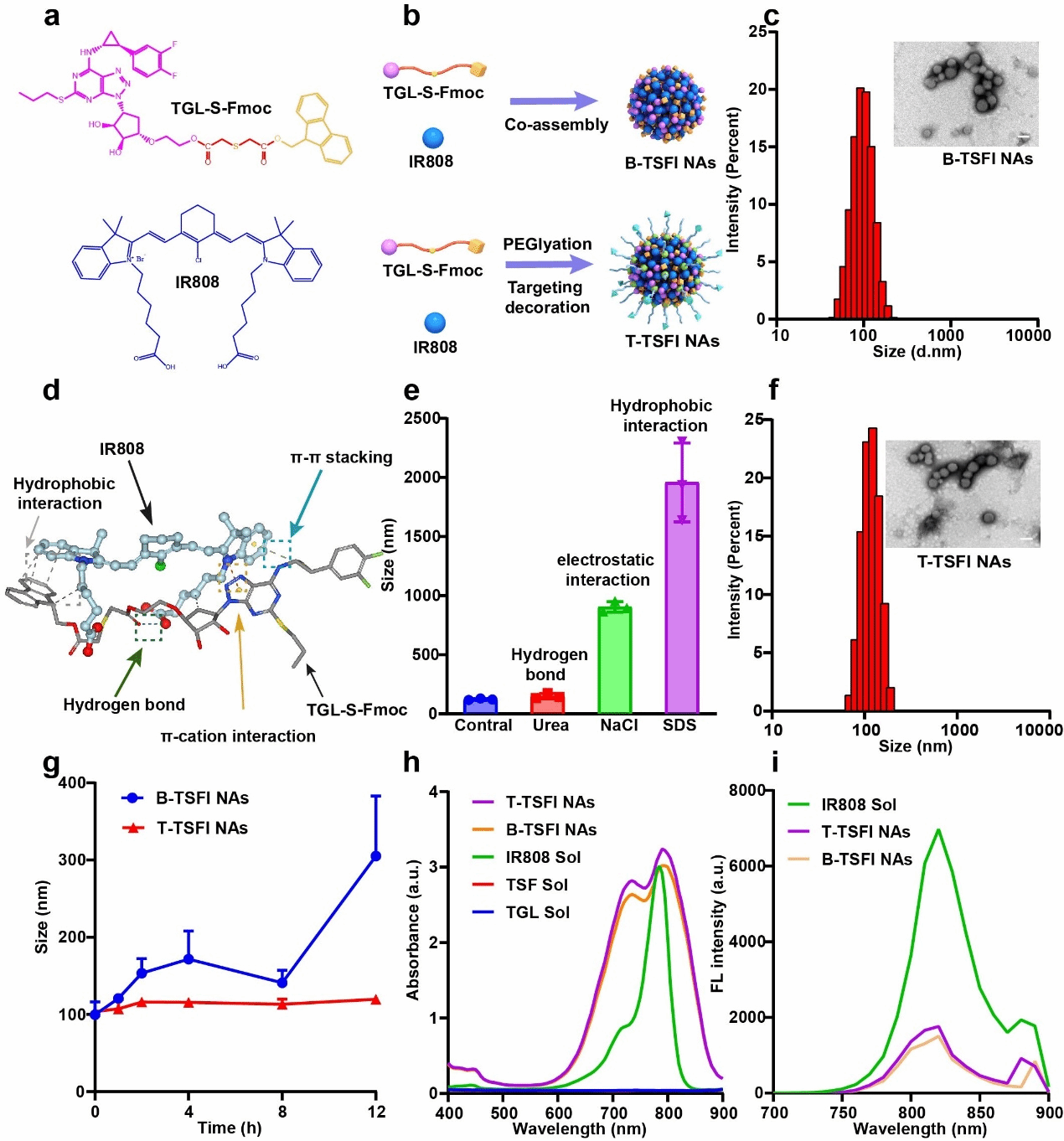
图2. 纳米组装体的制剂表征
考察了T-TSFI NAs的体外特性和体外溶栓能力。首先,验证了其体外光热和光动能力,发现其具备良好的体外升温能力,与TSF共组装后并没有影响IR808的光热转换效率,并且其产生1O2的能力较强。此外,渗透实验结果表明光热显著促进药物的深部渗透。(如图3所示)
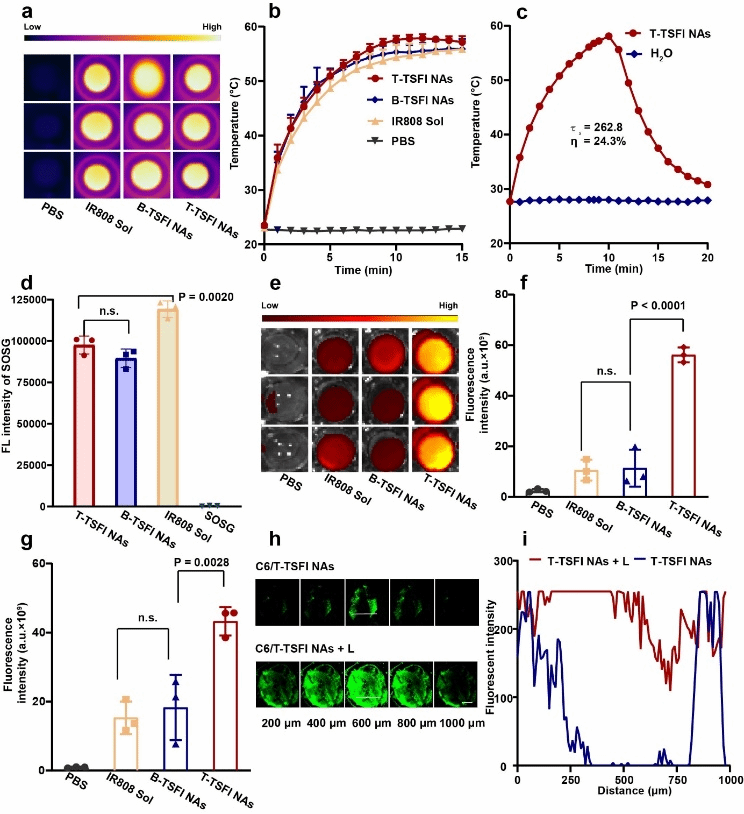
图3. 纳米组装体的体外光热、血栓靶向和深部渗透
进一步考察了T-TSFI NAs多模式驱动前药激活能力,药物释放结果表明其在近红外光照射下并联合H2O2能够实现95%以上的药物释放,展现了良好的共驱动释药行为。在体外溶栓实验中,光热发挥了举足轻重的作用,可观察到栓块的破裂,血红蛋白和纤维蛋白水平显著升高。体外抗血小板实验体现了前药纳米组装体的抗血小板能力,证实了前药发挥功能依赖于药物的有效激活。(如图4所示)

图4. 纳米组装体的体外药物释放与协同溶栓
此外,进一步考察了T-TSFI NAs体内性质。首先,选取Sprague-Dawley(SD)大鼠作为动物模型考察了前药纳米组装体的药动学行为,结果表明,具有聚乙二醇修饰的前药纳米组装体T-TSFI NAs体内循环时间显著延长,明显优于无靶向修饰的前药纳米组装体B-TSFI NAs和溶液剂组。进一步,建立了三氯化铁(FeCl3)诱导的大鼠颈动脉栓塞动物模型,考察了T-TSFI NAs的靶向分布成像、体内升温、溶栓能力和体内抗血小板效果。结果表明,经过DSPE-PEG2k和DSPE-PEG2K-CREKA修饰后,并以IR808自身荧光实现荧光成像,能够实现血栓部位的靶向蓄积。在近红外光照射下,具有良好药动学行为的前药纳米组装体表现出病灶温度显著升高。近红外光照射的组别有效促进前药激活,因此其具有最佳的溶栓能力和体内抗血小板效果。针对前药纳米组装体的安全性进行了考察,包括体外溶血、体外细胞安全性以及治疗后大鼠肝肾功能和主要器官H&E染色等层面进行评价,均未见明显异常,展现出良好的安全性。(如图5所示)
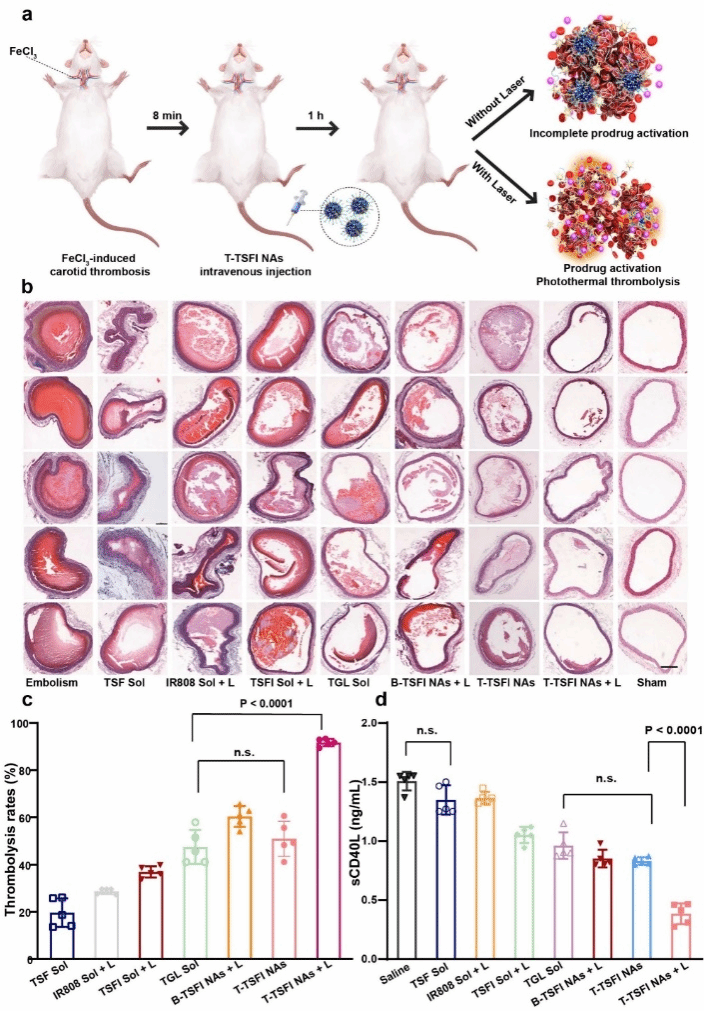
图5. FeCl3诱导的大鼠颈动脉血栓模型的溶栓验证
无涯创新学院2023级博士生张洪源和2021级硕士研究生王静为本文第一作者,罗聪教授为本文通讯作者,沈阳药科大学为论文唯一通讯单位。本研究得到了国家自然科学基金(项目编号:82161138029),沈阳市青年科技创新人才计划(项目编号:RC210452)和中日先进递药系统研究与转化国际联合实验室项目(项目编号:2024JH2/102100007)的资助支持。
原文链接:https://pubs.acs.org/doi/full/10.1021/acsnano.4c09986
辽宁省沈阳市沈河区文化路103号 | 邮编:110016
©2016 沈阳药科大学无涯创新学院 版权所有