无涯创新学院孙进/孙丙军团队在二聚体前药自组装纳米药物递送领域取得新进展
作者:无
日期:2024-02-25
浏览次数:
二聚体前药自组装纳米粒(DPNAs)由偶联两个药物分子的二聚体前药自组装形成,具有制备方法简单、载药量高、辅料相关毒性低等优点,是提高化疗药物治疗效率和安全性的有效策略。然而,合理设计DPNAs仍是一项巨大挑战。抗肿瘤二聚体前药的结构主体由药物分子组成,这严重限制了它们的自组装能力,影响体内命运。此外,前药能否在靶部位转化为活性药物并在正常器官组织中保持药理惰性也决定了其疗效和安全性。结合近年的研究经验,该团队概括性地总结出决定DPNAs疗效与安全性的三个关键指标:化学稳定性、组装稳定性和激活选择性,以评价DPNAs用于抗肿瘤治疗的应用前景。
二硫键具有接近90°的键角和二面角,可以有效提高前药的自组装能力。此外,二硫键能够响应肿瘤微环境特异性高表达的谷胱甘肽(GSH),被用作设计前药自组装纳米递送系统的“黄金标准”。该团队曾发现二硫键在前药中的位置(如相对于酯键的α-/β-/γ-位置)对DPNAs的化学稳定性、组装稳定性和激活选择性有显著影响(Nano Letters, 2018, 18(6): 3643-3650; Nature Communication, 2019, 10: 3211)。例如,γ-二硫键桥连DPNAs具有良好的化学稳定性,但是激活选择性不足,进而使其疗效受到影响;而可快速激活释放活性母药的α-二硫键桥连DPNAs具有较强的抗肿瘤效果,但是化学稳定性较差,存在血液等环境中脱靶释放的问题,可能带来安全隐患。在前期工作中,该团队利用三硫键独特的含硫二面角和GSH高敏感性,突破“黄金标准”,制备了兼具高载药量、高自组装稳定性和高肿瘤选择性三大优势的前药自组装纳米递送系统,引发了广泛的关注,同时也将多硫键在DPNAs的应用带入大众视线中(Science Advances, 2020, 6(45): eabc1725; Nature Communications, 2022, 13(1): 7228; Nano Today, 2022, 44: 101480)。
2024年2月21日,沈阳药科大学孙进/孙丙军团队在Cell旗下子刊《Cell Reports Medicine》(IF=14.3)发表题为“Tetrasulfide bond boosts the anti-tumor efficacy of dimeric prodrug nanoassemblies”的研究文章,进一步探讨四硫键在构建前药自组装纳米递送系统中的应用。沈阳药科大学无涯创新学院孙进教授和孙丙军教授为此文通讯作者,2021级博士生左诗意为第一作者,沈阳药科大学为唯一通讯单位。

在这项研究中(图1),作者设计了一系列四硫键桥连卡巴他赛(CTX)二聚体前药,系统地考察了四硫键的化学位置对于DPNAs的影响。在综合化学稳定性和激活选择性等因素后,选择了最具潜力的γ-4S-2CTX,并设计了相应二硫键/三硫键桥连前药作为对照。与三硫键和二硫键相比,四硫键赋予DPNAs更强的自组装能力,保证了DPNAs在体内的稳定性。值得注意的是,四硫键具有超高还原反应性,使DPNAs成为高选择性的“肿瘤炸弹”,可以被肿瘤部位的高水平GSH选择性“引爆”,释放毒性CTX杀伤肿瘤细胞。此外,该团队还提出了一种“火上浇油”的策略,通过补充外源还原剂来进一步加强肿瘤部位的还原应激,加速γ-4S-2CTX NPs的活化,从而获得更好的抗肿瘤效果,并同时提高了其肿瘤选择性。
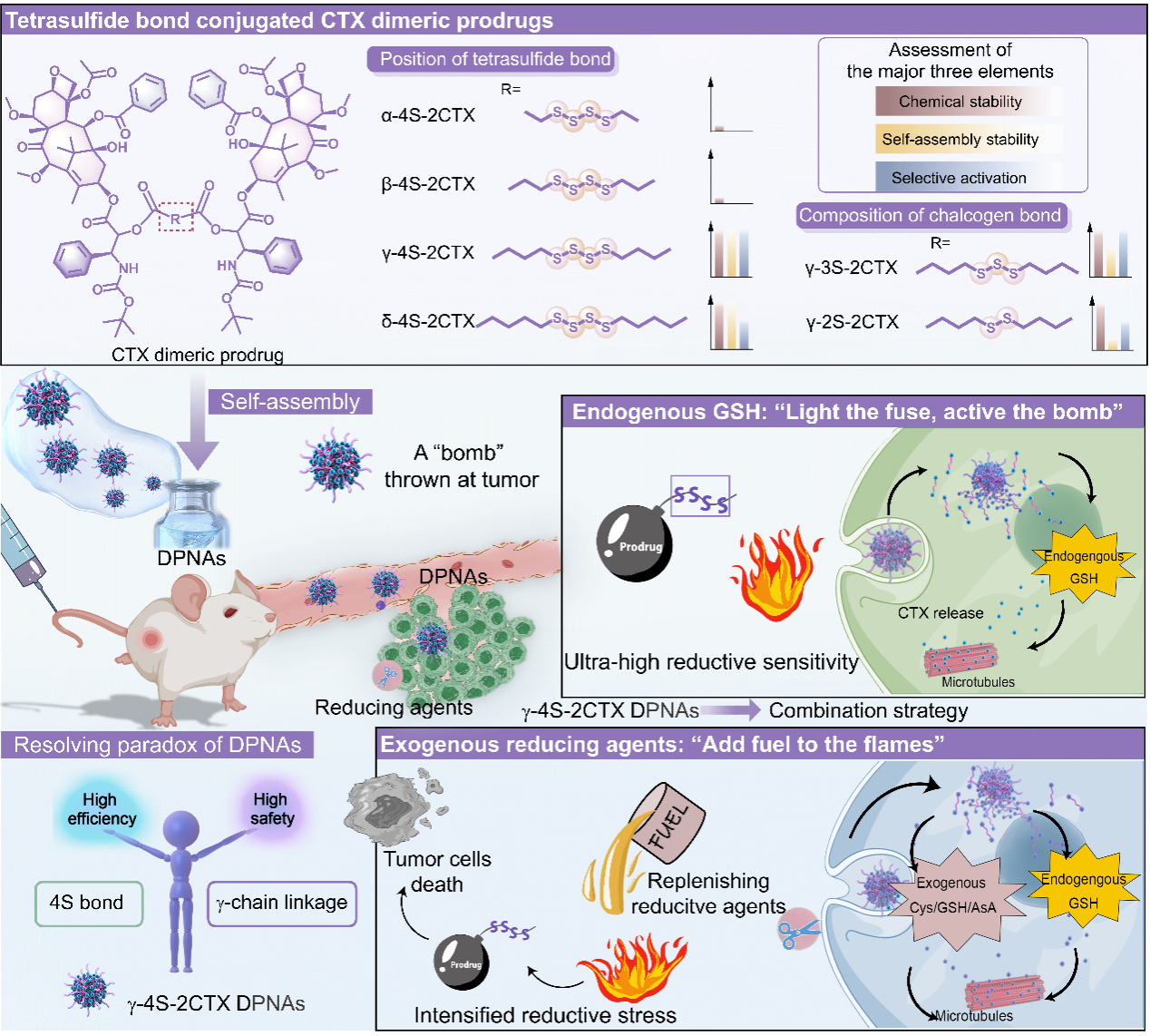
图1. 四硫键提高DPNAs的抗肿瘤效果
γ-4S-2CTX较长的γ-四硫键连接保证了其体内稳定性和安全性。同时,超高还原反应性的四硫键使γ-4S-2CTX NPs可以被肿瘤中的内源性GSH选择性地“引爆”,杀伤肿瘤细胞。为了充分发挥DPNAs的潜力,向肿瘤部位补充外源性还原剂,如同"火上浇油",进一步引发γ-4S-2CTX NPs的活化,从而获得更好的抗肿瘤效果。
作者首先合成了一系列卡巴他赛二聚体前药,并对其化学稳定性及组装能力进行考察。结果表明,四硫键的引入使DPNAs在自组装方面具有明显优势,这对提高药物递送效率非常重要。通过对组装机制的探索,揭示了卡巴他赛二聚体前药结构-组装关系,解释了四硫键桥连DPNAs具有更好自组装稳定性的机制(图2)。

图2. 四硫键提高二聚体前药组装稳定性及其机制探索
作者接着考察了前药自组装纳米粒的体外释放行为,结果如图3所示。γ-4S-2CTX NPs表现出超高还原反应性,对于多种还原物质(谷胱甘肽GSH、半胱氨酸Cys和抗坏血酸AsA)都具有良好的响应能力。与三硫键/二硫键相比,四硫键超高的还原反应性可归因于以下三点:(1)四硫键的硫原子都表现出较高的价轨道电负性,表明它们非常容易受到GSH的亲核攻击;(2)四硫键具有更多的硫原子,尤其是活性更高中心硫原子;(3)四硫键在还原反应过程中释放更多H2S,从热力学角度该反应更容易进行。

图3. 四硫键桥连前药的体外还原响应释放及机制
接下来,作者对前药自组装纳米粒的药动学行为和组织分布进行了考察(图4)。具有良好化学稳定性和自组装稳定性的四硫键保证了DPNAs在体内的稳定性,延长了血液循环时间,从而改善其肿瘤蓄积。

图4. 四硫键桥连前药自组装纳米粒的体内药动学和组织分布
体外细胞试验(图5)显示,由于具有更强的激活选择性,γ-4S-2CTX NPs表现出了更强的抗肿瘤活性和肿瘤细胞选择性。此外,作者提出“火上浇油”策略,通过补充外源性还原物质进一步增强肿瘤还原应激,提高前药自组装纳米粒的抗肿瘤作用。结果表明,“火上浇油”策略成功地激发了四硫键连接的DPNAs的治疗潜力,并具有良好的安全性。

图5. 四硫键桥连前药自组装纳米粒单独及联合外源还原剂的体外抗肿瘤作用
作者接着考察了四硫键前药自组装纳米粒的体内抗肿瘤效果,尤其是“火上浇油”策略在体内的应用效果(图6和图7)。在两种异种瘤移植模型中,γ-4S-2CTX NPs均表现出较其它前药自组装纳米粒更强的抗肿瘤效果,有效地抑制了肿瘤的生长,且在与外源性还原物质联合后获得了更好的治疗效果。

图6. 四硫键桥连前药自组装纳米粒单独及联合外源还原剂的体内抗肿瘤作用(前列腺癌模型:RM-1)

图7. 四硫键桥连前药自组装纳米粒单独及联合外源还原剂的体内抗肿瘤作用(乳腺癌模型:4T1)
该工作得到了国家重点研发计划(NO. 2022YFE0111600)、国家自然科学基金(NO. 82272151, 82204318)、辽宁省博士科研启动基金(NO. 2021-BS-130)、辽宁省教育厅高等学校基本科研项目(NO. LJKZ0953)和沈阳市中青年科技创新人才支持计划(NO. RC220389)的支持。
原文链接:https://doi.org/10.1016/j.xcrm.2024.101432
辽宁省沈阳市沈河区文化路103号 | 邮编:110016
©2016 沈阳药科大学无涯创新学院 版权所有