无涯创新学院孙进/罗聪团队在肿瘤疫苗佐剂开发领域取得新进展
作者:无
日期:2024-02-28
浏览次数:
在新兴的肿瘤治疗策略中肿瘤疫苗因其诱导肿瘤特异性免疫反应的能力而受到关注。 肿瘤疫苗通过刺激免疫细胞产生抗原特异性 T 细胞,增强免疫原性,抵消肿瘤诱导的免疫抑制,可控制或消除肿瘤,并最终降低癌症发病率。然而,传统的疫苗设计受到复杂性和低效性的困扰。传统的纳米疫苗需要同时加载抗原和佐剂,使设计过程变得复杂。 此外,这些成分之间的物理和化学差异常常导致共递送的失败,例如发生佐剂的泄漏和抗原的失活等,这使大规模生产、除菌和储存变得复杂化。为了克服这些挑战,开发高效、多功能的肿瘤疫苗平台需要将佐剂功能集成到递送系统中,即构建自佐剂材料,以简化疫苗的设计和制备。
含胍基的材料和分子由于其强大的生物活性而在癌症治疗中引起了广泛关注。一个典型的例子是二甲双胍,作为广泛认可的抗糖尿病药物,除了其血糖调节作用外,二甲双胍还具有降低癌症发病率的能力,这是由于二甲双胍治疗会导致肿瘤微环境重新编程并增加其他治疗药物的敏感性。除了临床应用之外,含胍基生物材料还具有独特的功能。 例如,胍离子在生理环境中表现出卓越的稳定性,与阴离子生物分子形成牢固的盐桥。含有多个胍基团的材料与生物分子的结合增强,使其成为多功能的载体。然而,尽管具有这些特性,但聚胍材料对免疫系统的直接影响,特别是它们作为疫苗载体的应用,仍然是一个相对未充分开发的领域,具有巨大的潜力。
2024年2月26日,沈阳药科大学孙进/罗聪团队在美国化学会旗下期刊《ACS Nano》(IF=17.3)发表题为“Self-Adjuvanting Polyguanidine Nanovaccines for Cancer Immunotherapy”。我校无涯创新学院孙进教授和罗聪教授,新加坡国立大学陈小元教授为本文通讯作者,博士毕业生张轩博,王开元及2023级博士生赵志强为本文共同第一作者,沈阳药科大学为第一通讯单位。

在这项工作中(图1),作者通过用不同的胍基基序修饰支链聚乙烯亚胺(PEI)来设计聚胍(PolyGu)自佐剂纳米疫苗载体,并使用蛋白和mRNA抗原制备纳米疫苗以探索其免疫活性。 使用卵清蛋白(OVA)作为模型抗原,通过简单的混合过程制备纳米疫苗,并研究了它们对肿瘤免疫治疗的体外和体内影响。结果表明,胍修饰显着增强了PEI的安全性,有效激活树突状细胞(DC)并促进其成熟。 作者还证明这种免疫激活是由 TLR4 和 NLRP3 途径介导的。 此外,多价胍纳米疫苗表现出强大的体内免疫活性。 皮下注射自佐剂多价胍疫苗可在淋巴组织中有效蓄积,从而能够在免疫小鼠中特异性清除表达 OVA 的细胞。 在 B16-OVA 肿瘤模型中,多价胍自佐剂疫苗和 PD-L1 抗体的组合显示出对 B16 肿瘤生长的显著抑制并延长了小鼠的存活时间。 此外,作者进一步探索了多胍材料作为 mRNA 疫苗载体的潜力,也取得了良好的结果。
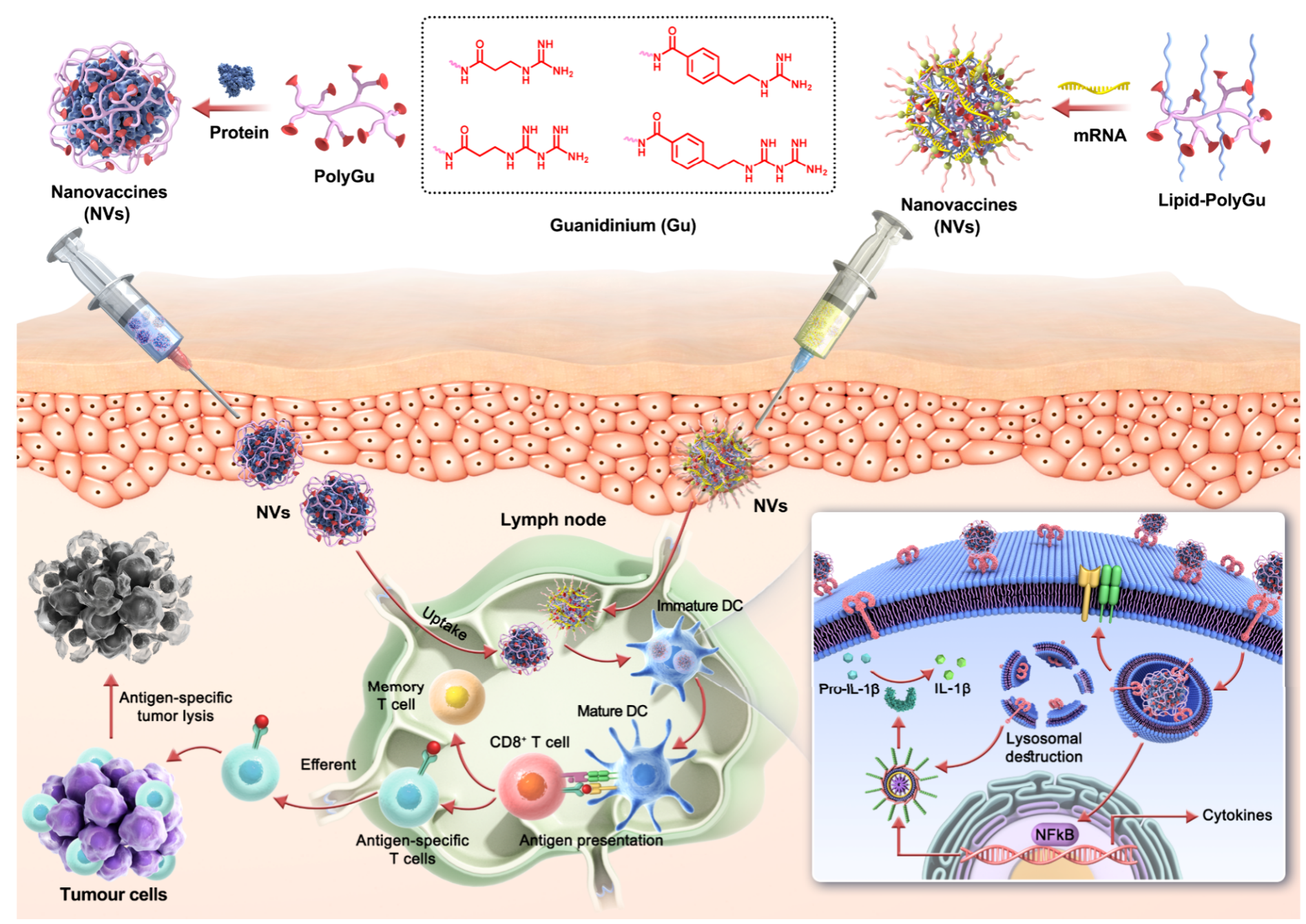
图1. 构建多胍肿瘤纳米疫苗平台,整合佐剂于疫苗递送载体。
多胍纳米疫苗主要基于多价苯乙双胍(Poly-PBG),并通过 TLR4 和 NLRP3 途径激活树突状细胞,从而产生强大的体内免疫反应。 它们能有效抑制肿瘤并延长小鼠的存活时间。 这些 多胍材料也有望增强基于 mRNA 的纳米疫苗,为个性化癌症疫苗建立平台。
作者首先选择支链PEI作为主要框架,并用功能性胍基团对其进行修饰来构建多胍材料。随后,使用卵清蛋白 (OVA) 作为模型抗原制备了纳米疫苗。首先,作者使用小鼠骨髓来源性树突状细胞 (BMDC) 和巨噬细胞 (BMDM) 检查了胍修饰对 PEI 毒性的影响。结果显示,胍修饰大大减轻了 PEI 的毒性。进一步研究了胍 纳米疫苗对 BMDC 的免疫刺激作用。 结果发现,多胍NVs 可促进 DC 成熟,其共刺激分子 CD80 和 CD86 在 BMDCs 中显着上调,此外,多胍疫苗在促进 DC 抗原呈递方面也表现出更好的效率。这些免疫激活的提升可能与良好的摄取有关。在NVs 处理 DCs后,DCs在刺激 T 细胞增殖方面表现出显著提升的效率。
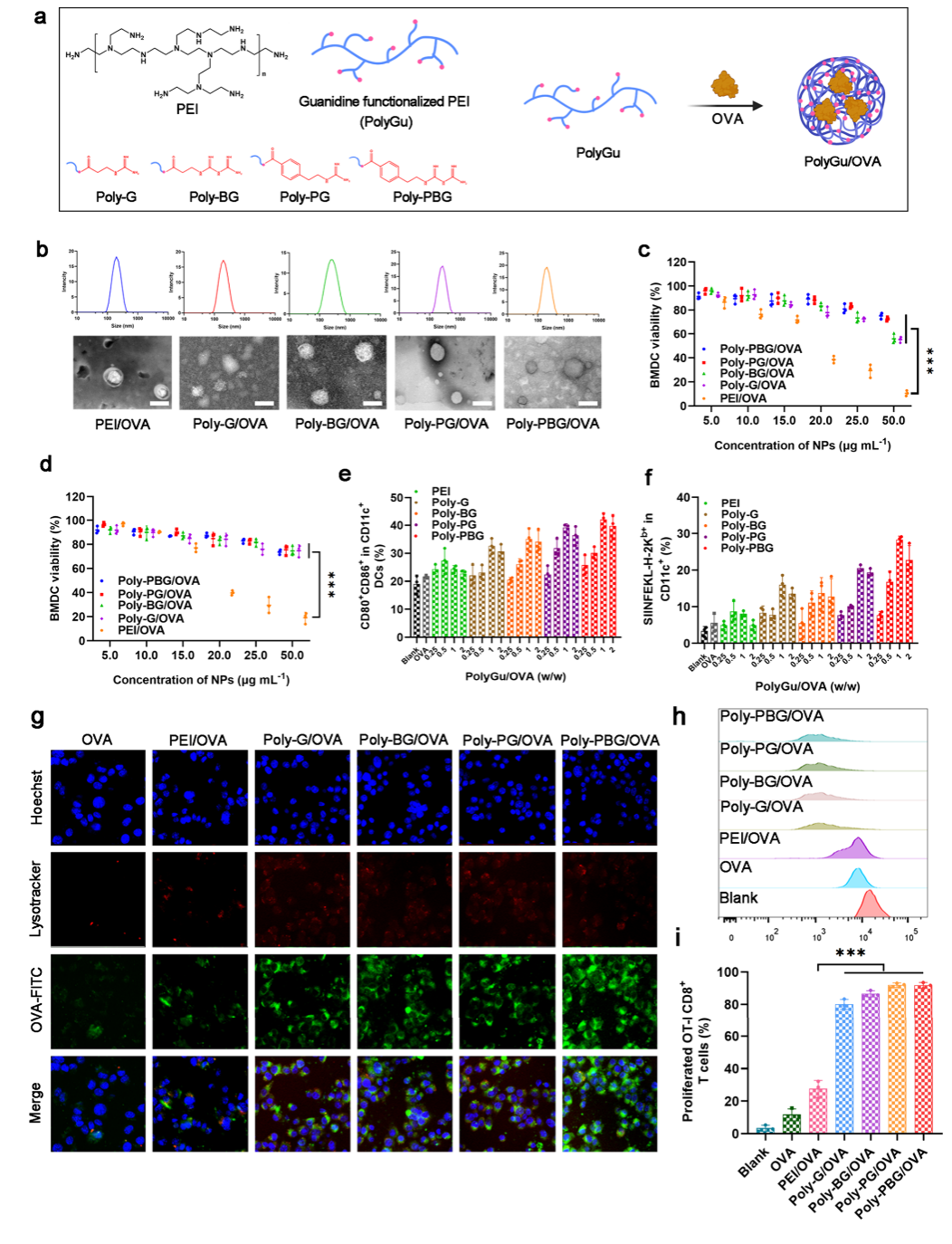
图2. 多胍疫苗的合成与表征。
作者猜想这些富含阳离子的PolyGu NVs可以激活细胞内模式识别受体,从而促进DCs的成熟并通过下游信号通路促进抗原呈递。 因此,作者首先测量了经 PolyGu NV 处理的 DC 的细胞因子分泌情况。 结果显示,PolyGu NV 显着增强 DC 分泌 IL-1β、IL-6 和 IL-12。 因此,作者推测PolyGu NVs对DCs的激活主要是通过丝裂原激活蛋白激酶(MAPK)途径实现的,并通过蛋白质印迹实验进一步验证了这一点。此外,利用几种典型的TLR和STING抑制剂进行验证,结果显示,TLR4抑制剂和NOD样受体3(NLRP3)抑制剂显著减少了PolyGu NV对DC的激活。
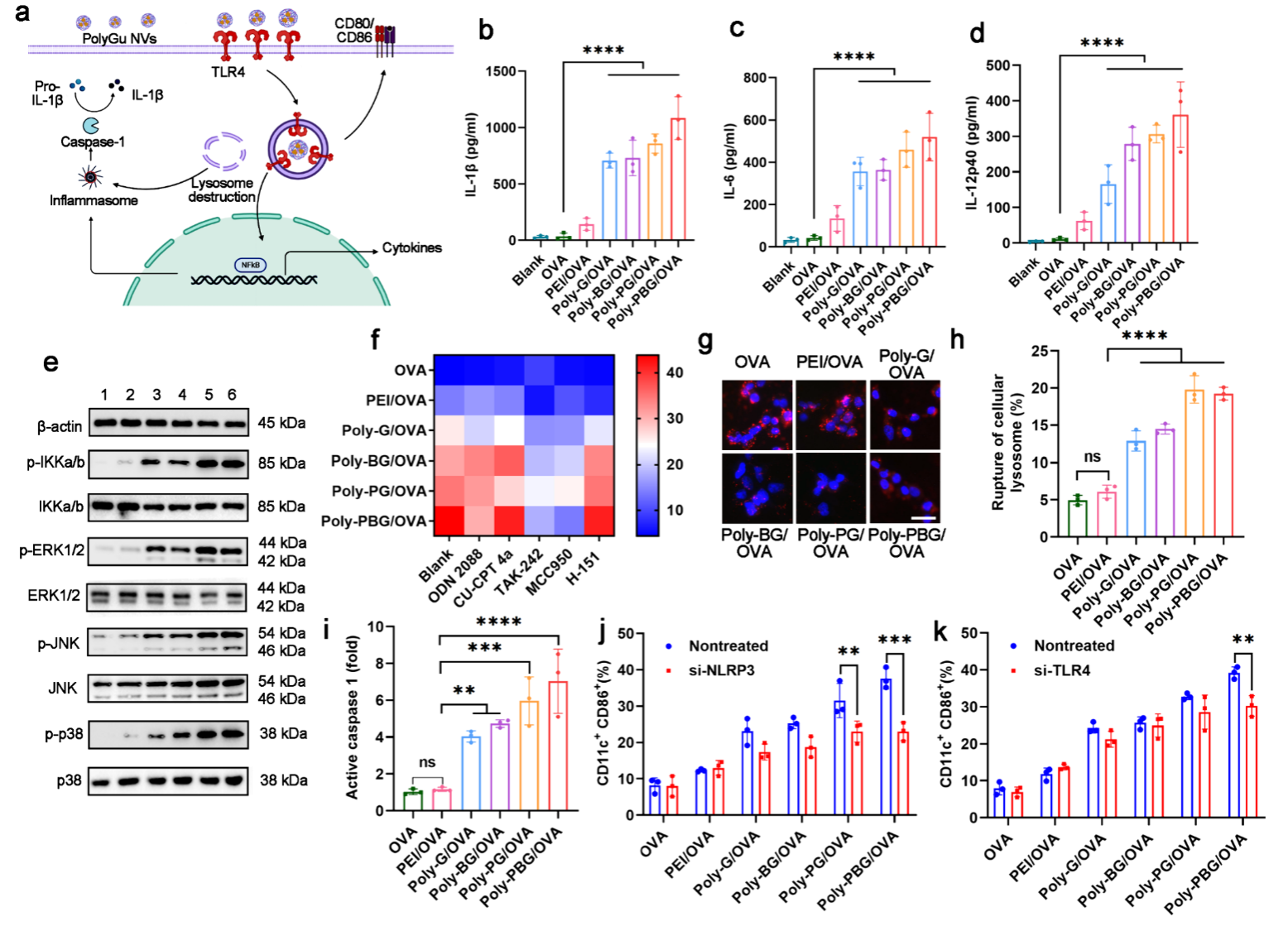
图3. PolyGu NVs 通过多种信号通路激活 BMDCs。
考虑到 PolyGu NV 的体外良好的免疫活性和安全性,作者进一步研究了它们在体内诱导特异性抗肿瘤免疫反应的能力。 首先,作者证明了PolyGu NV的淋巴结靶向能力。 随后,作者进一步评估了接种疫苗后淋巴结中免疫细胞的激活情况。 结果显示,NVs注射可诱导引流淋巴结中DCs的成熟,促进DCs的抗原呈递。 成熟的DC可以激活CD8+T细胞并促进特定CD8+T细胞的增殖,这将有利于体内特异性肿瘤杀伤。为了直接验证 PolyGu NV 诱导的这种特异性 CTL 反应的效率,作者研究了用不同疫苗免疫的小鼠的特异性细胞毒性。体内结果表明,所有PolyGu NVs都能诱导超过50%的特异性细胞毒性,PBG NVs在小鼠体内诱导特异性细胞毒性的效率达到80%。 这些结果表明 PolyGu NV 作为癌症疫苗抑制肿瘤进展的潜力。
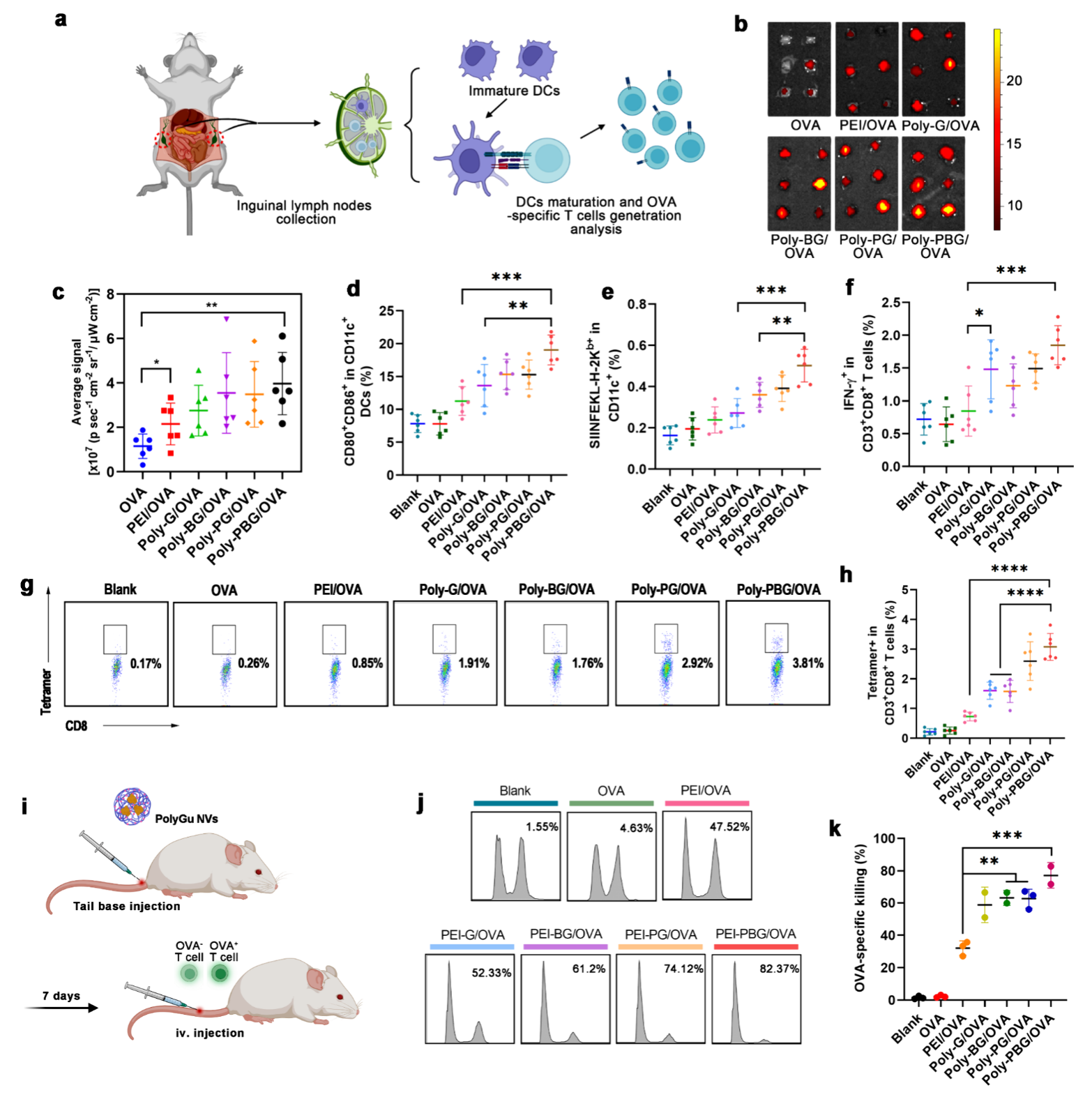
图4. PolyGu-NV 的体内淋巴结靶向和抗原特异性 T 细胞诱导。
为了进一步验证 PolyGu NV 诱导的特异性抗肿瘤免疫作用,作者研究了它们在表达模型抗原 OVA (B16-OVA) 的黑色素瘤小鼠模型中的治疗效果。 结果显示,用PolyGu NVs免疫的小鼠,尤其是用PG NVs和PBG NVs免疫的小鼠,肿瘤生长率显着降低,这显着提高了小鼠的存活率。 此外,这些疫苗还展示良好的体内安全性。 由于Poly-PBG NVs的良好应用潜力,作者进一步将Poly-PBG NVs与PD-L1抗体结合,并将其与市售佐剂进行比较,结果显示, Poly-PBG NVs 和 PD-L1 的组合优于 CpG/OVA 和 PD-L1 的组合。
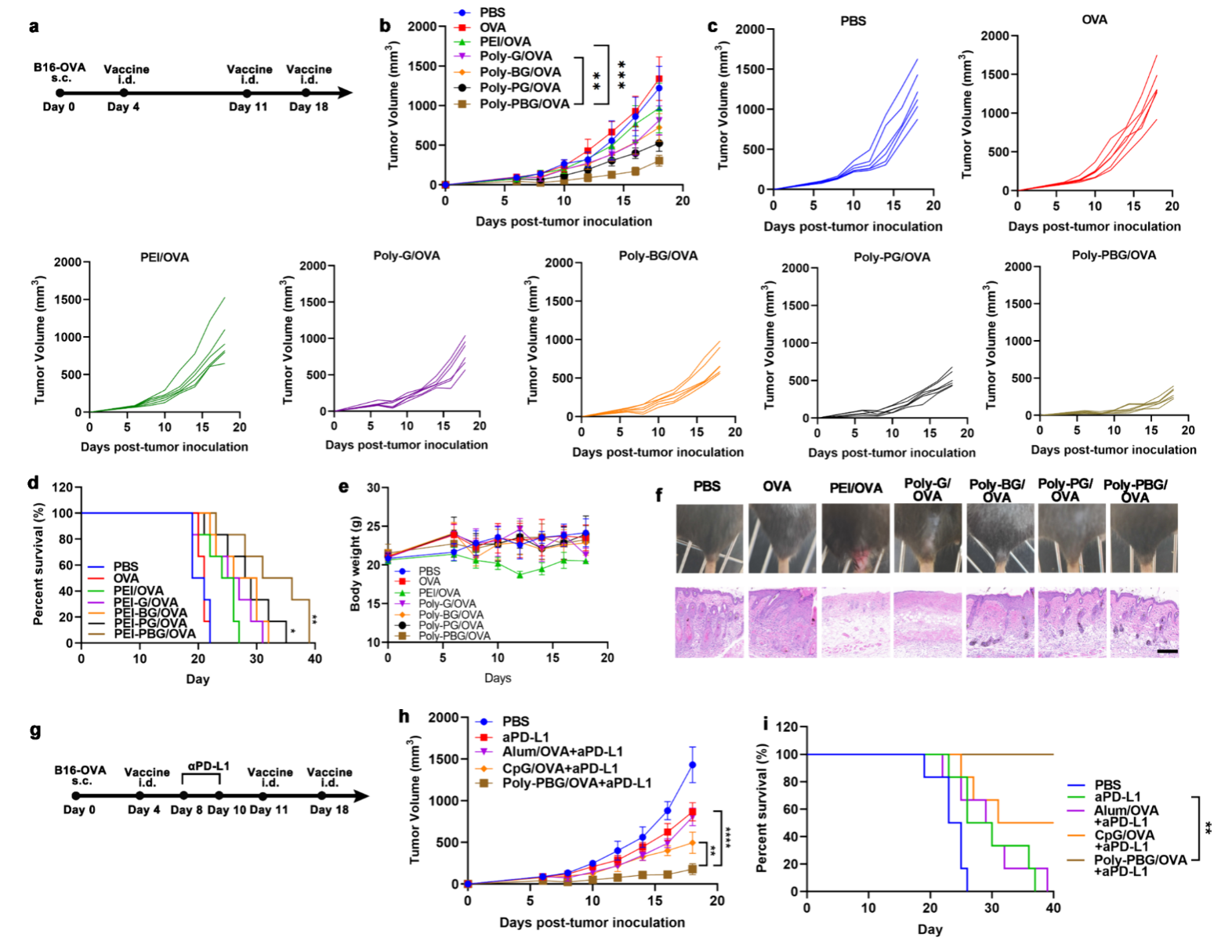
图5. PolyGu NVs 有效抑制肿瘤生长并显着延长荷瘤小鼠的生存期。
为了扩大基于PolyGu的自佐剂的用途,作者探索了基于Poly-PBG的mRNA载体效果。 以OVA mRNA作为模型,并使用十六烷酸(C16)将Poly-PBG修饰为Poly-PBG-C16,以提高mRNA的递送效率。 作者制备了 EGFP mRNA (mEGFP) NV,并使用 HEK-293T 细胞进行体外转染实验。 体外转染显示,Poly-PBG-C16可接近Lipo-2000的效率。 以mOVA NVs 考察了 BMDC 细胞模型中的抗原呈递效果,结果表明 Poly-PBG-C16 促进了抗原表达和呈递。 此外,用 Poly-PBG-C16/mOVA 免疫小鼠可诱导适应性免疫反应,显着抑制肿瘤生长,表明这种基于胍的佐剂材料可以作为 mRNA 疫苗的有效载体。
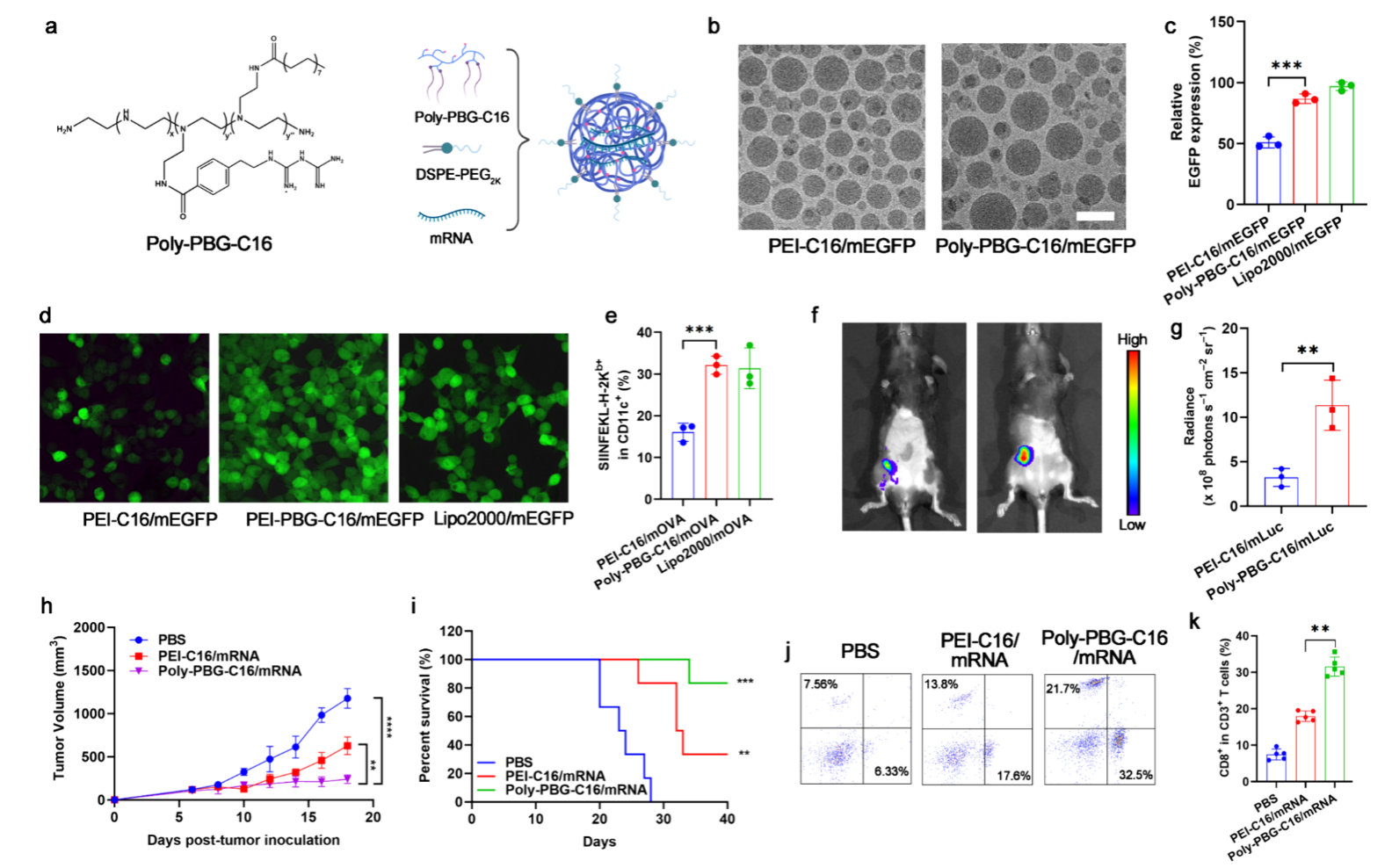
图6. 用于 mRNA NV 递送的 Poly-PBG-C16。
该工作得到了国家重点研发计划(NO. 2021YFA0909900)等项目的支持。
原文链接:https://doi.org/10.1021/acsnano.3c11637
辽宁省沈阳市沈河区文化路103号 | 邮编:110016
©2016 沈阳药科大学无涯创新学院 版权所有