我院何仲贵/孙进/罗聪团队在超分子前药纳米组装领域取得新进展
作者:无
日期:2024-05-29
浏览次数:
癌症的免疫疗法通过激活人体内的免疫系统识别和清除肿瘤细胞。这种新型的治疗模式在临床实践中已被证实其有效性。然而,免疫治疗的临床结果千差万别,因为肿瘤的免疫原性和免疫微环境各异,导致在不同患者和癌症类型中治疗效果差异很大,甚至从完全治愈到响应率极低。具有时空可控特性的光动力学治疗(PDT)除了可以直接杀伤肿瘤细胞,还能够诱导肿瘤免疫原性细胞死亡(ICD)来有效提高免疫原性,促进损伤相关分子模式(DAMPs)的大量暴露,进而诱导树突状细胞(DCs)成熟,并随后触发效应T细胞的激活,最终增强细胞毒性T淋巴细胞(CTLs)介导的抗肿瘤免疫治疗效果。然而,PDT增强的抗肿瘤免疫反应受到肿瘤微环境(TME)中免疫抑制因子过度激活的影响,特别是吲哚胺2,3-双加氧酶(IDO)的过量产生和程序性细胞死亡配体1(PD-L1)的上调。因此,在诱导ICD的同时抑制IDO至关重要,这将有利于增敏PD-1/PD-L1抗体药物免疫检查点阻断。因此人们开始致力于开发共同递送光动力光敏剂和IDO抑制剂的纳米药物。

2024年5月6日,沈阳药科大学何仲贵/孙进/罗聪团队在爱思唯尔旗下期刊《Nano Today》(IF=17.4)发表题为“Cascaded multiresponsive supramolecular dimer-engineered nano-modulator enabling spatiotemporally adaptable tumor immune microenvironment remodeling in photodynamic immunotherapy”研究型论文,我校无涯创新学院孙进教授、罗聪教授和何仲贵教授为本文通讯作者,2021级博士生王悦全为本文第一作者,沈阳药科大学为第一通讯单位。
在这项研究中(图1),作者首次发现了一种“超二聚体”驱动的新型纳米组装模式并构建了一种具有时空自适应级联释药特性的超分子纳米组装体,用于高效共递送光敏剂PPa与IDO抑制剂NLG919,并进一步与PD-L1抗体进行联用,以激活免疫反应并同时逆转免疫抑制微环境,从而增强肿瘤的光动-免疫治疗效果。合成了单硫键桥连的IDO抑制剂NLG919同源二聚体前药(NLG-S-NLG, NSN)与二硫键桥连的环糊精(CD)-PPa偶联物(PPa-SS-CD, PSSC),首次发现了两分子PSSC与一分子NSN可以形成一种“超二聚体”结构,具有良好的纳米组装特性,基于此构建了一种新型的超分子纳米组装体(PSSC@NSN NAs)。值得注意的是,CD的引入不仅可以通过主-客体包合作用精确地驱动超分子纳米组装,而且还可以在没有PEG聚合物修饰的情况下赋予纳米组装亲水性表面,实现稳定组装与递送。在肿瘤细胞中高GSH存在时,PSSC中的二硫键作为触发纳米组装解体的“一级开关”,有效缓解PPa的聚集诱导淬灭(ACQ)效应并促进1O2的产生和ICD的诱导效果。PPa产生的1O2和肿瘤细胞中高内源性ROS协同开启NSN中的单硫键“二级开关”,促进NLG919的快速释放。因此,超分子纳米组装体通过“两级开关”的引入可以级联实现ACQ缓解、ICD诱导、NLG919释放和IDO抑制,在两种荷瘤小鼠模型中均表现出良好的抗肿瘤效果,并与PD-L1抗体联合展现出协同治疗作用。

图1. 实现级联增强光免疫治疗的时空自适应超二聚体纳米组装示意图
作者发现PSSC无法自组装成纳米粒,然而与一分子NLG919单体可以共组装成纳米粒。尽管稳定性不佳,但NLG919的加入确实促进了PSSC的纳米组装,可能是由于NLG919与CD形成的主客体包合作用介导了超分子纳米组装。基于上述实验结果,作者进一步设想将两分子的NLG919进行偶连后合成NLG919的同源二聚体前药,具有两个环己基的同源二聚体与两分子PSSC组装时形成一个大体积的超分子二聚体(我们定义为“超二聚体”)结构,这样一个“超二聚体”可能更有利于纳米组装。进一步地,作者对“超二聚体”的纳米组装机制进行了深入的探讨。结果表明主客体包合作用、“超二聚体”介导的“桥接作用”、π-π堆积相互作用和疏水相互作用为主要驱动力(图2)。
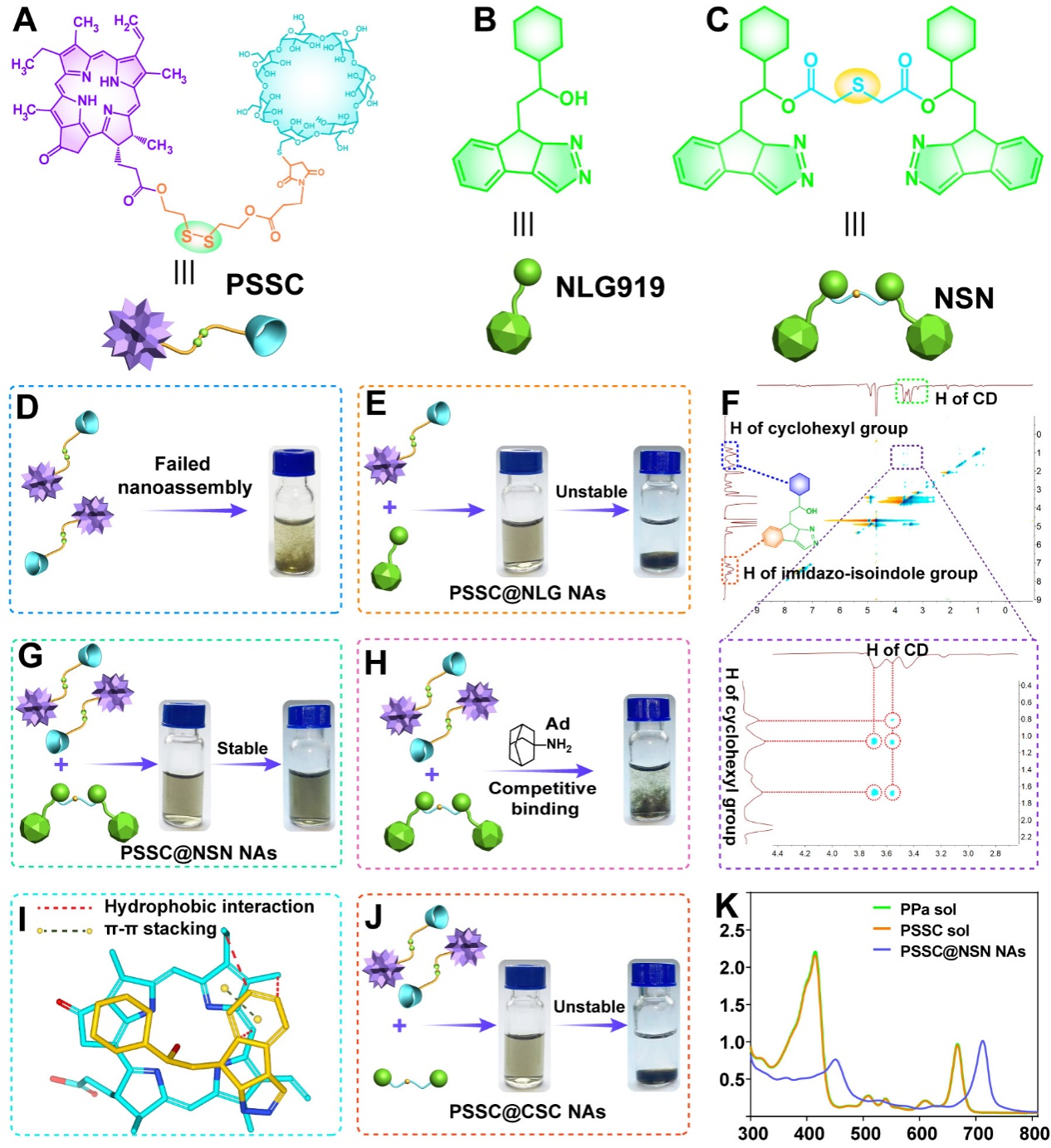
图2. 超二聚体驱动纳米组装的发现及纳米组装机理的研究
接下来,作者考察了超分子纳米组装体的时空可控的级联药物激活,结果如图3所示。在还原环境中二硫键断裂促进超分子纳米组装体解体有效缓解了PPa的ACQ效应,产生1O2能力显著增强,而H2O2的加入和近红外照射均能够使NSN中的单硫键断裂,实现NLG919的释放,并且呈现时间依赖性。进一步地,同时加入H2O2和进行近红外光照射能够进一步加速NLG919的释放,并且在与DTT共孵育后缓解ACQ效应后再联合H2O2和近红外光照射后显示出更高的释放速率,实现了时空级联药物激活。
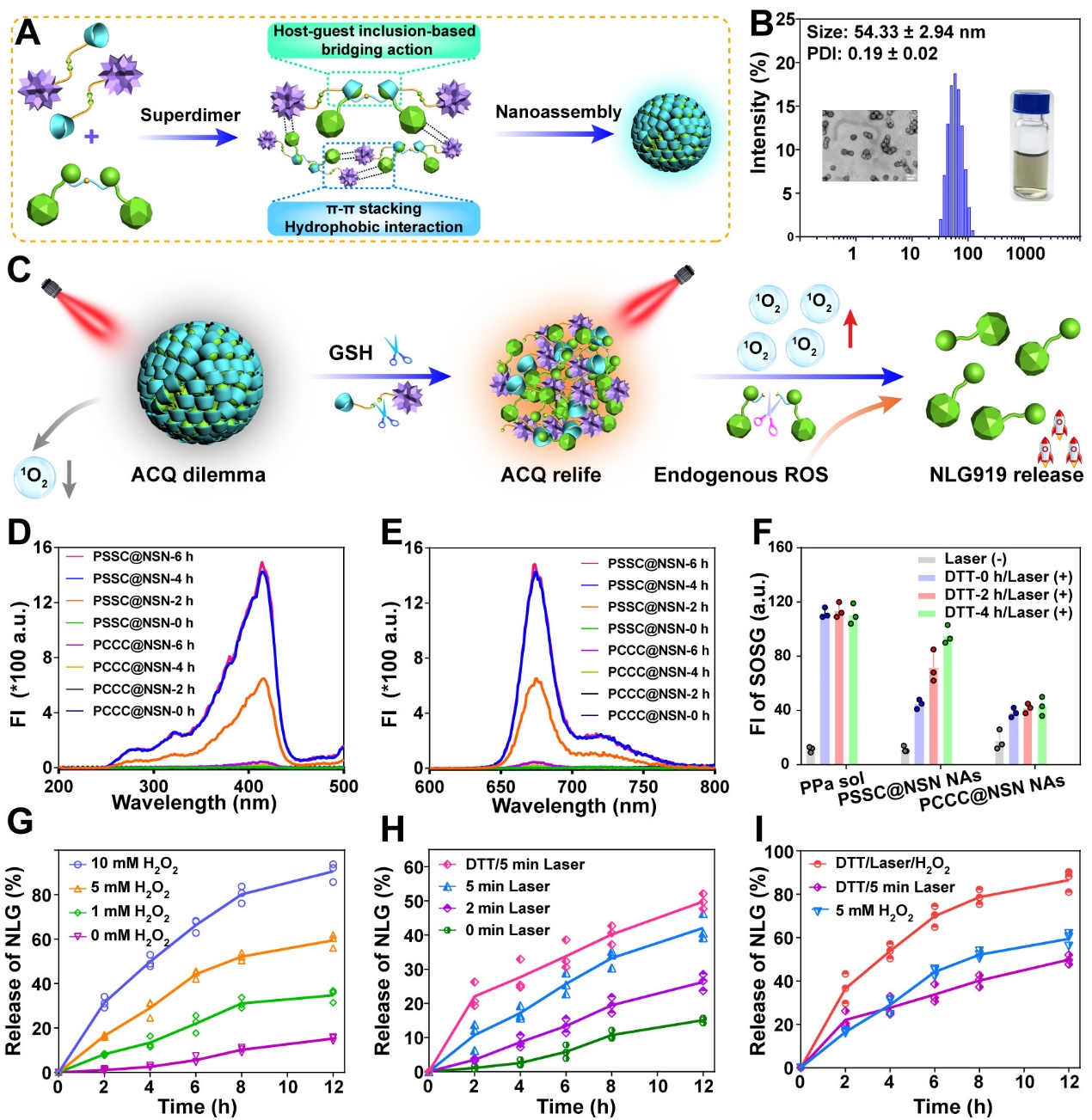
图3. 超分子纳米组装体的制备与表征及体外药物级联激活
作者接着考察了超分子纳米组装体的细胞摄取行为及体外抗肿瘤作用。结果表明,相比于PPa溶液剂,纳米组装体具有更高的细胞摄取效率,并显示出显著增强的细胞毒性、显著促进了细胞调亡与胞内ROS产生(图4)。
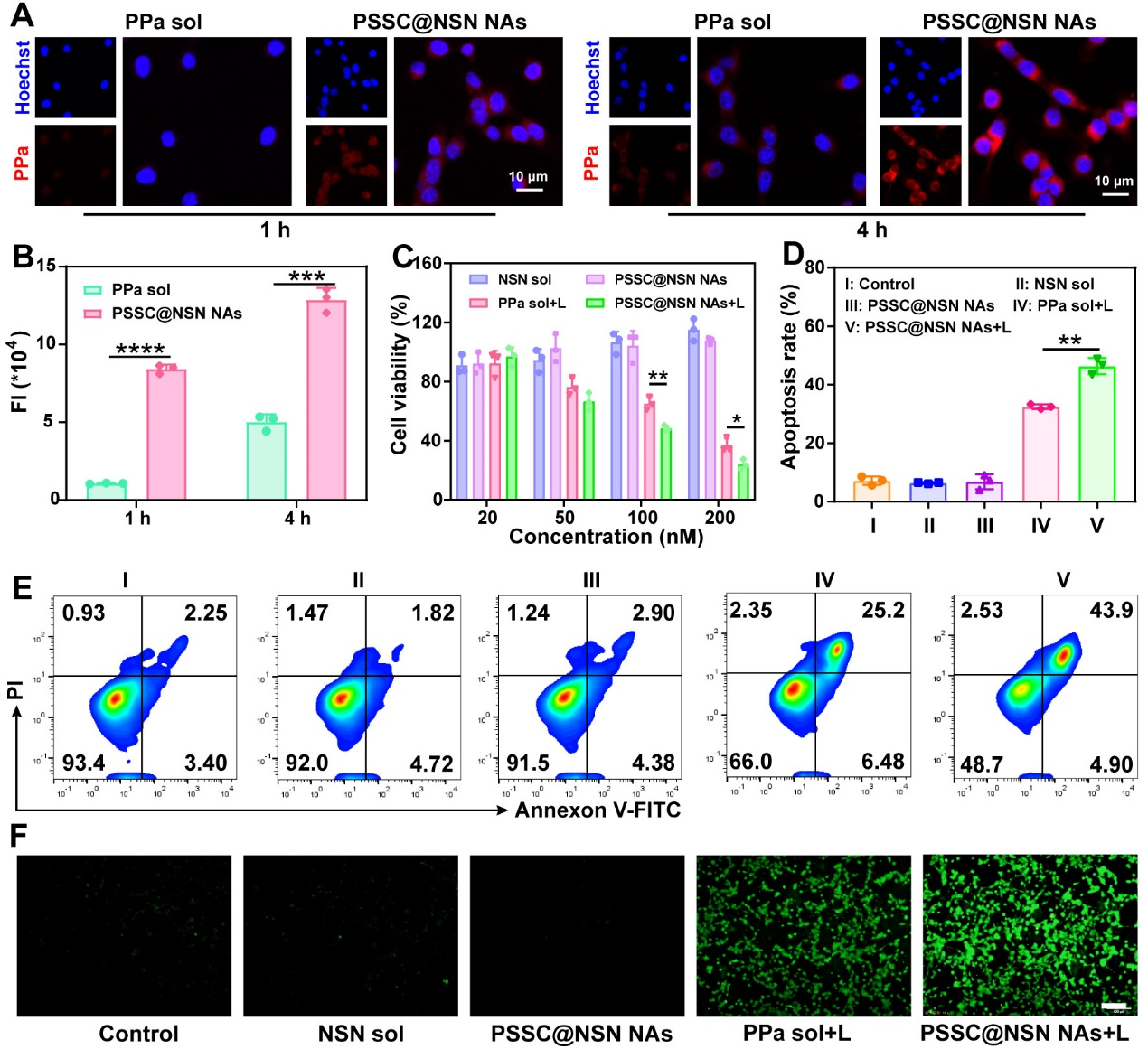
图4. 超分子纳米组装体的细胞摄取及体外抗肿瘤作用
由于超分子纳米组装体具有高效的细胞摄取效率与胞内ROS产生能力,而PDT产生的ROS不仅仅可以直接杀伤细胞,还可通过触发包括CRT、HMGB1和ATP在内的DAMPs的产生,有效诱导肿瘤细胞的ICD,从而诱发抗肿瘤免疫反应。图6实验结果表明超分子纳米组装体显示出强效的ICD诱导效果,显著促进了DCs成熟。
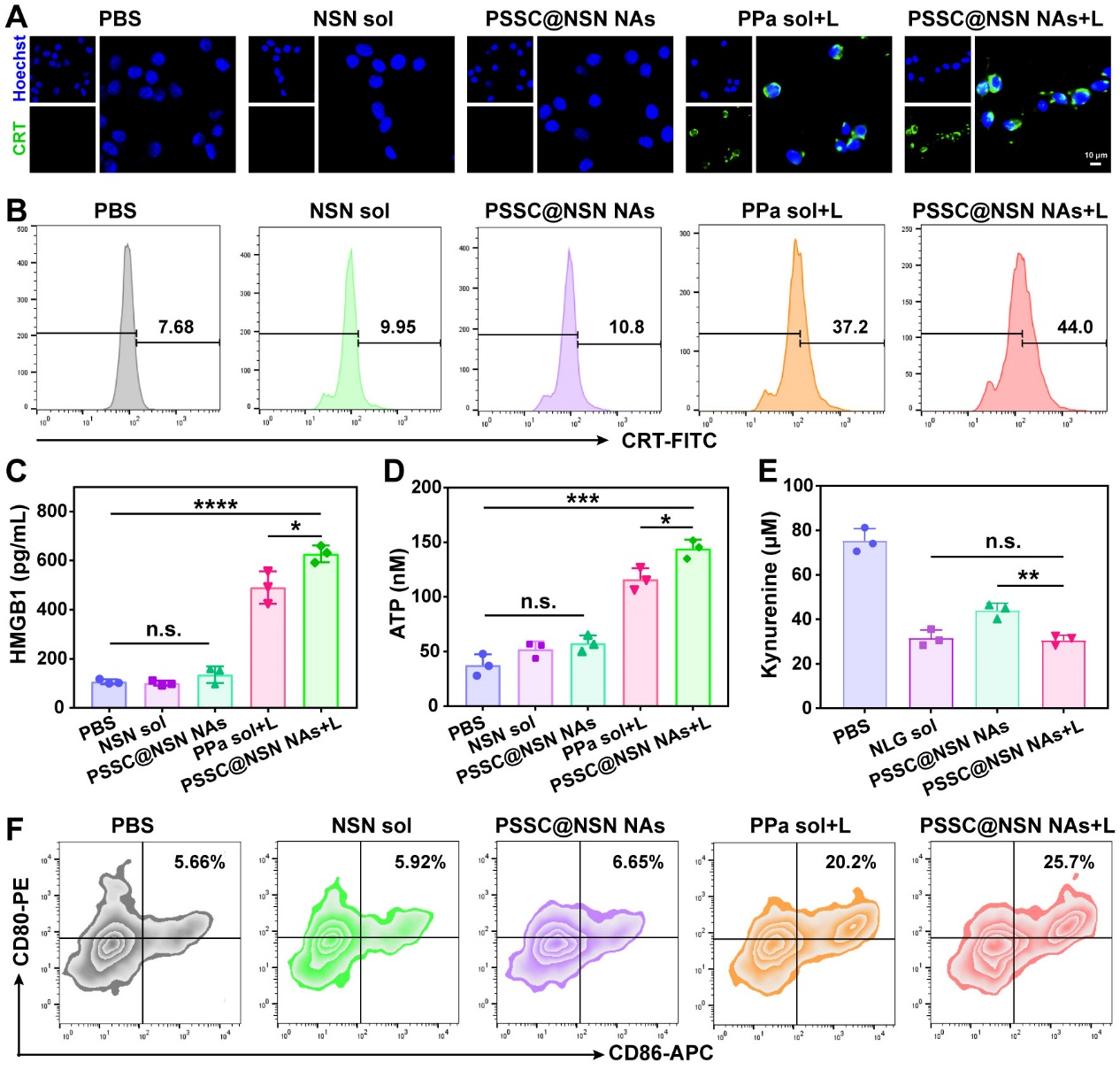
图5. ICD诱导和DCs成熟
作者接下来考察了超分子纳米组装体的组织分布行为(图6)。相比之下,这种具有CD赋予亲水性表面的“超二聚体”保证了在体内的稳定性,增强了在肿瘤部位的蓄积。为了进一步对时空级联增强光免疫治疗进行体内评价,作者考察了在CT26结肠荷瘤小鼠模型中的抗肿瘤作用并深入探究了体内抗肿瘤机制。结果显示超分子纳米组装体在近红外光照射下显示出最强的抗肿瘤效果,显著提升肿瘤引流淋巴节中成熟DCs的比例、肿瘤浸润T淋巴细胞的比例,降低肿瘤中Treg细胞的比例产生了强大的体内免疫激活反应(图6)。
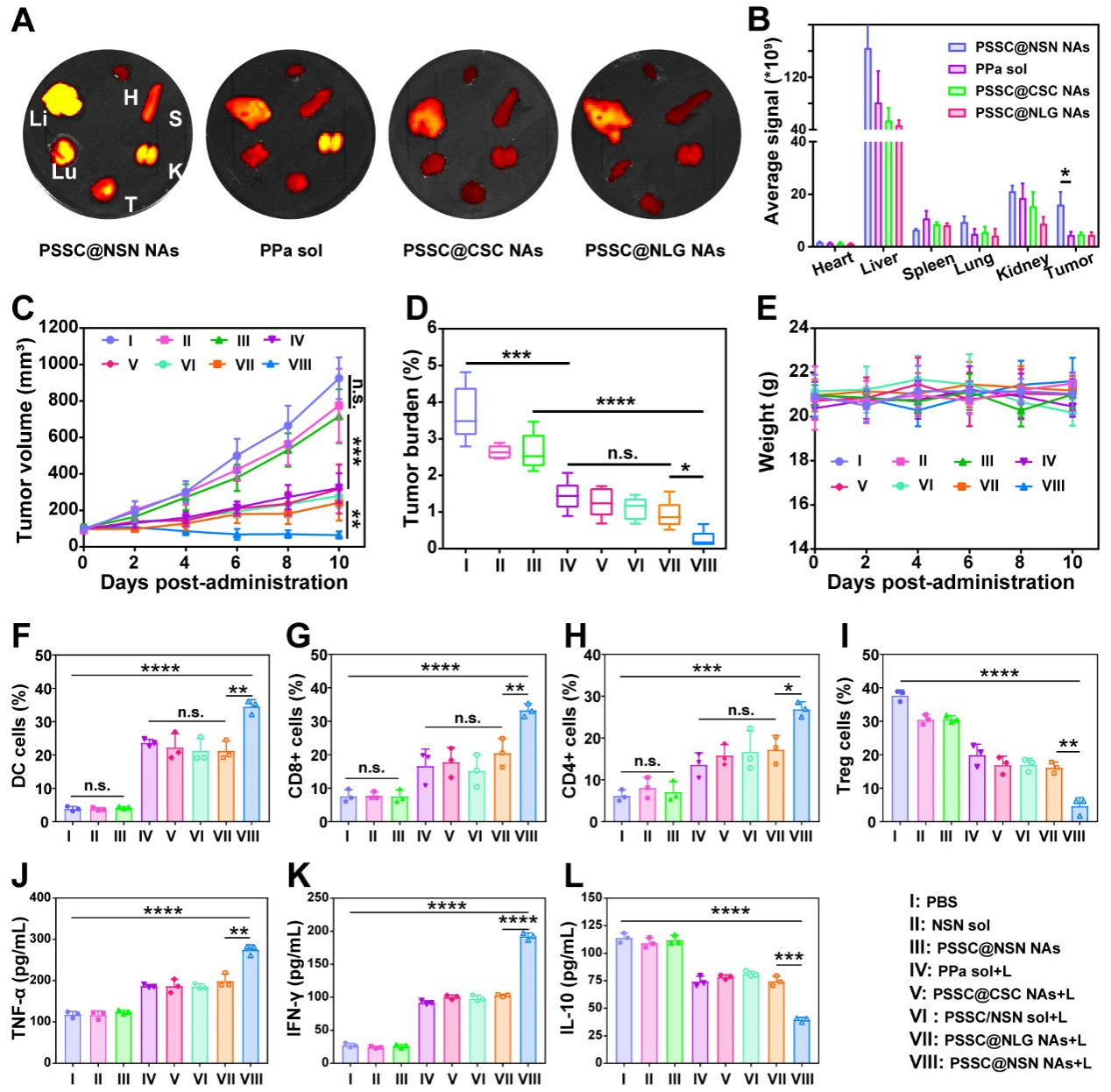
图6. 组织分布、光免疫治疗和体内抗肿瘤机制
鉴于在体内诱发的强大免疫反应,作者进一步评估超分子纳米组装体诱导全身免疫反应抑制远端肿瘤的潜力,结果显示在双侧皮下CT26荷瘤小鼠模型中对原发肿瘤和远端肿瘤都显示出强大的抑制作用,并具有良好的安全性(图7)。由于在诱导ICD和逆转免疫抑制微环境方面令人鼓舞的结果,作者猜想这种超分子纳米组装体可能会增敏PD-1/PD-L1抗体介导的免疫检查点阻断疗法并建立了肺转移性B16-F10肿瘤模型。结果显示在近红外光的照射下,超分子纳米组装体联合PD-L1抗体在肿瘤生长抑制和肺转移方面明显优于单一治疗组,这种联合闭环治疗模式,显著增强了肿瘤免疫治疗效果和抑制了肿瘤肺转移(图8)。
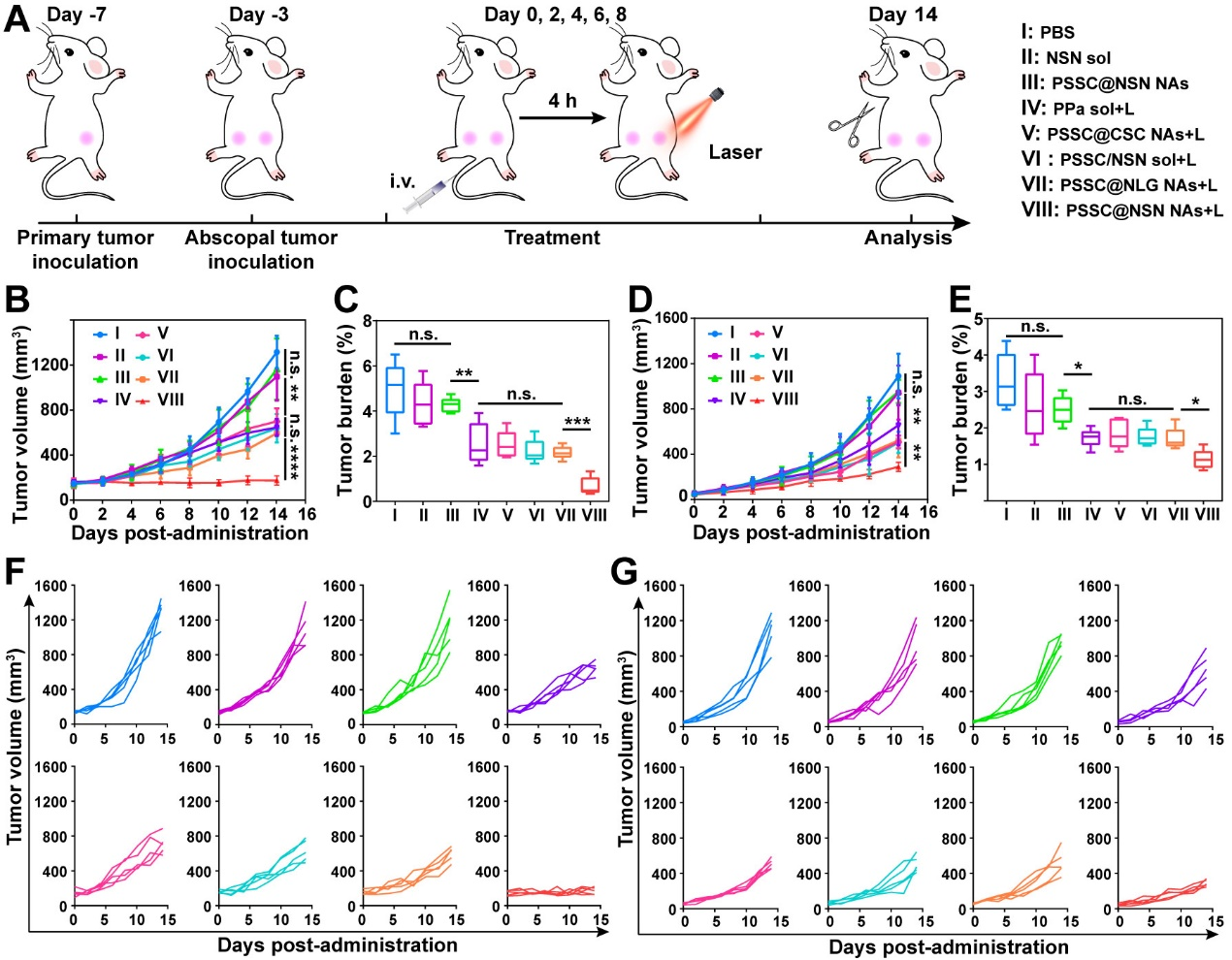
图7. 远端肿瘤生长抑制
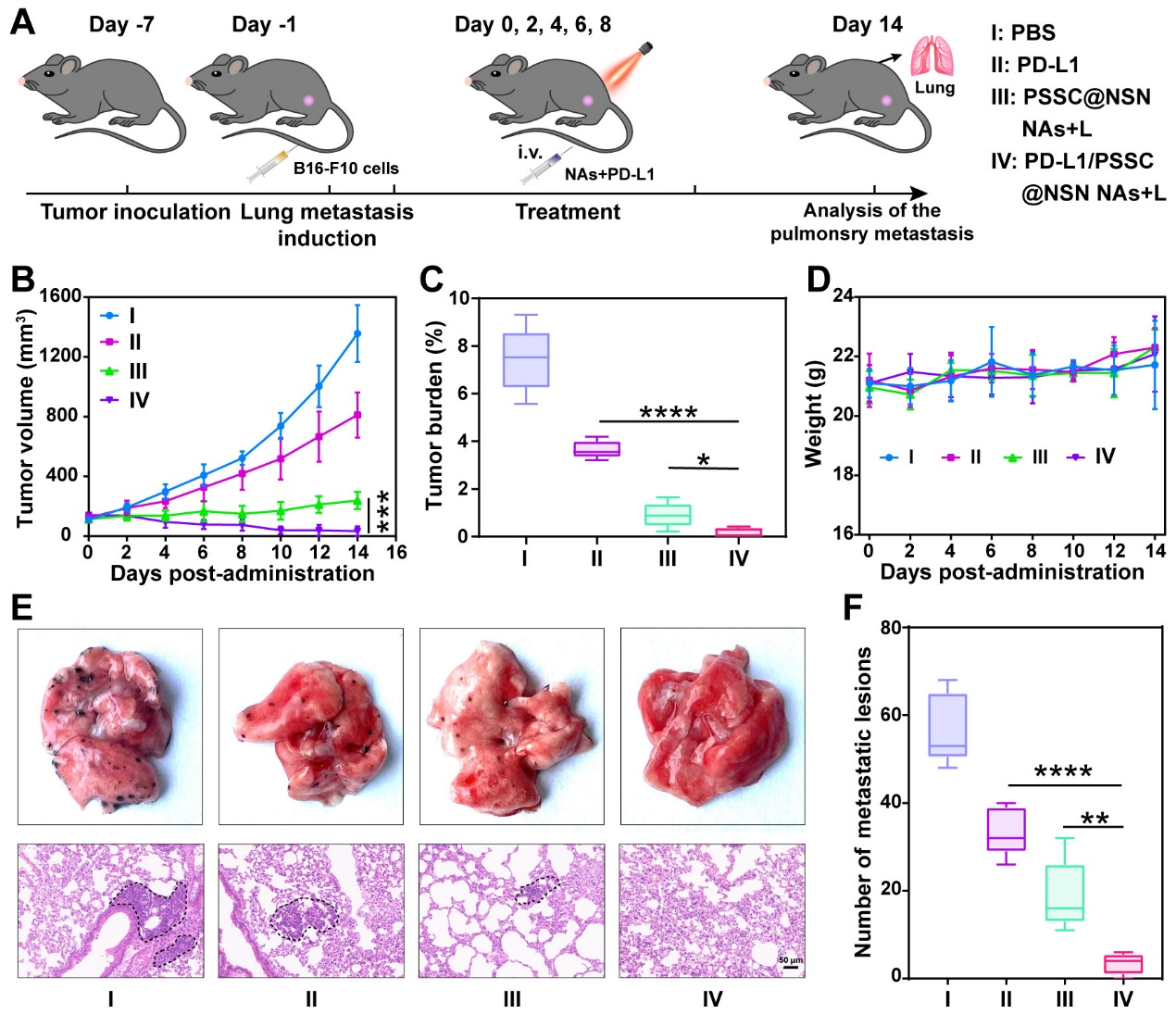
图8. 抗PD-L1协同肿瘤免疫治疗
该工作得到了国家自然科学基金项目(No. 82161138029、No. 82204317)、辽宁省教育厅基础研究项目(No. LJKZZ20220109)、沈阳市中青年科技创新人才计划项目(No. 82kzz20220109)资助。
原文链接:https://doi.org/10.1016/j.nantod.2024.102305
辽宁省沈阳市沈河区文化路103号 | 邮编:110016
©2016 沈阳药科大学无涯创新学院 版权所有