无涯创新学院孙丙军团队在小分子前药纳米组装体领域取得新进展:表面功能化模块在前药开发中的重要性
作者:张睿
日期:2024-06-17
浏览次数:
小分子前药自组装纳米粒以简易的制备工艺、高载药量和低载体相关毒性等优势,已发展为极具前景的药物递送系统,并展现出良好的临床应用潜力。前药纳米粒的设计有望触发药物在肿瘤微环境中特异性释放,而在正常组织中保持稳定,实现高效治疗的同时降低毒副作用。前药纳米粒的高效性能源于其精巧的模块化设计,包括:药物模块、修饰模块、响应模块和表面功能化模块。其中,表面功能化模块,以聚乙二醇(PEG)为代表,在纳米粒设计中扮演着至关重要的角色。PEG能在纳米粒表面形成亲水层,防止纳米粒的非特异性聚集和免疫识别。DSPE-PEG2k作为市场上首选的PEG衍生物,已被广泛应用于多种上市纳米制剂中,如Doxil®和Onivyde®。PEG修饰策略不仅延长了纳米粒在血液中的循环时间,还减少了网状内皮系统(RES)的清除作用,从而提高了药物的治疗效果。合理调整DSPE-PEG2k的比例对于前药纳米粒的组装稳定性、细胞摄取、药代动力学和疗效等有着显著影响。因此,精确控制表面功能化模块的用量对纳米粒有着至关重要的作用。
近日,沈阳药科大学无涯创新学院孙丙军教授在美国化学会旗下纳米科学和纳米技术顶级期刊《Nano Letters》(IF=10.8)在线发表题为“Probing the Impact of Surface Functionalization Module on the Performance of Mitoxantrone Prodrug Nanoassemblies: Improving the Effectiveness and Safety”的研究论文,设计了不同比例的表面功能化模块(DSPE-PEG2k)修饰的米托蒽醌前药自组装纳米粒,发现表面功能化模块的占比会显著影响前药自组装纳米粒的制剂学特征和体内命运。
在这项研究中,作者利用前药自组装纳米粒的模块化设计原理,选择米托蒽醌为药物模块,二硫键为响应模块,辛基十二醇为修饰模块,合成了米托蒽醌前药。为探究表面功能化模块对纳米粒的关键作用,通过一步纳米沉淀法制备了5种不同比例DSPE-PEG2K(0%,10%, 20%, 40%, 60%,W/W)修饰的前药自组装纳米粒,即0% NPs, 10% NPs, 20% NPs, 40% NPs和60% NPs(图1)。作者通过探究制剂的基本表征、细胞毒性、药物动力学、药效学等性质,阐述了表面功能化模块对纳米粒的影响。
结果表明,随着表面功能化模块比例的升高,纳米粒的粒径呈现先下降后上升的趋势,其中40% NPs呈现出最小的粒径。在胶体稳定性考察中,表面功能化模块的比例与稳定性成正相关,PEG的比例越高纳米粒的稳定性越好。在细胞和药动学实验中,40% NPs在肿瘤选择性和药代动力学特性方面展现出了显著的优势。在药效学研究中,40% NPs不仅表现出更高的耐受剂量,还显示出更好的安全性和良好的抗肿瘤效果。
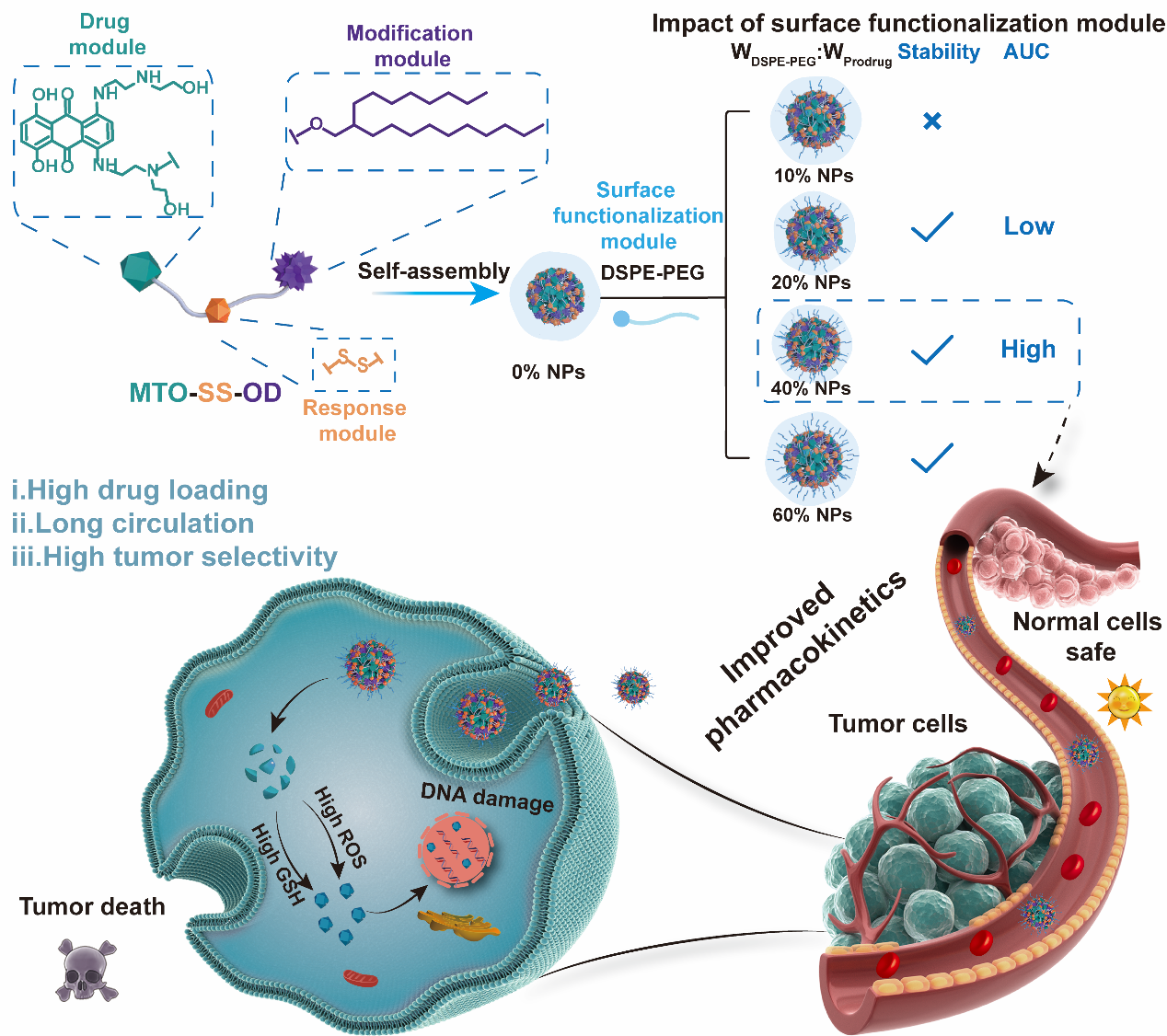
图1. 表面功能化模块对米托蒽醌前药自组装纳米粒的影响。
作者首先合成了二硫键桥联的米托蒽醌-辛基十二醇前药,以此制备了一系列DSPE-PEG2K(0%, 10%, 20%, 40%, 60%, W/W) 修饰的前药自组装纳米粒,其粒径从200 nm到140 nm不等。其中40% NPs具有最小的粒径和良好的稳定性。此外,在组装机制的考察中,作者发现疏水作用力在纳米粒的组装过程中起到了关键作用(图2)。综合考虑制剂学特征和载药量,选取20% NPs和40% NPs用于后续的实验研究。
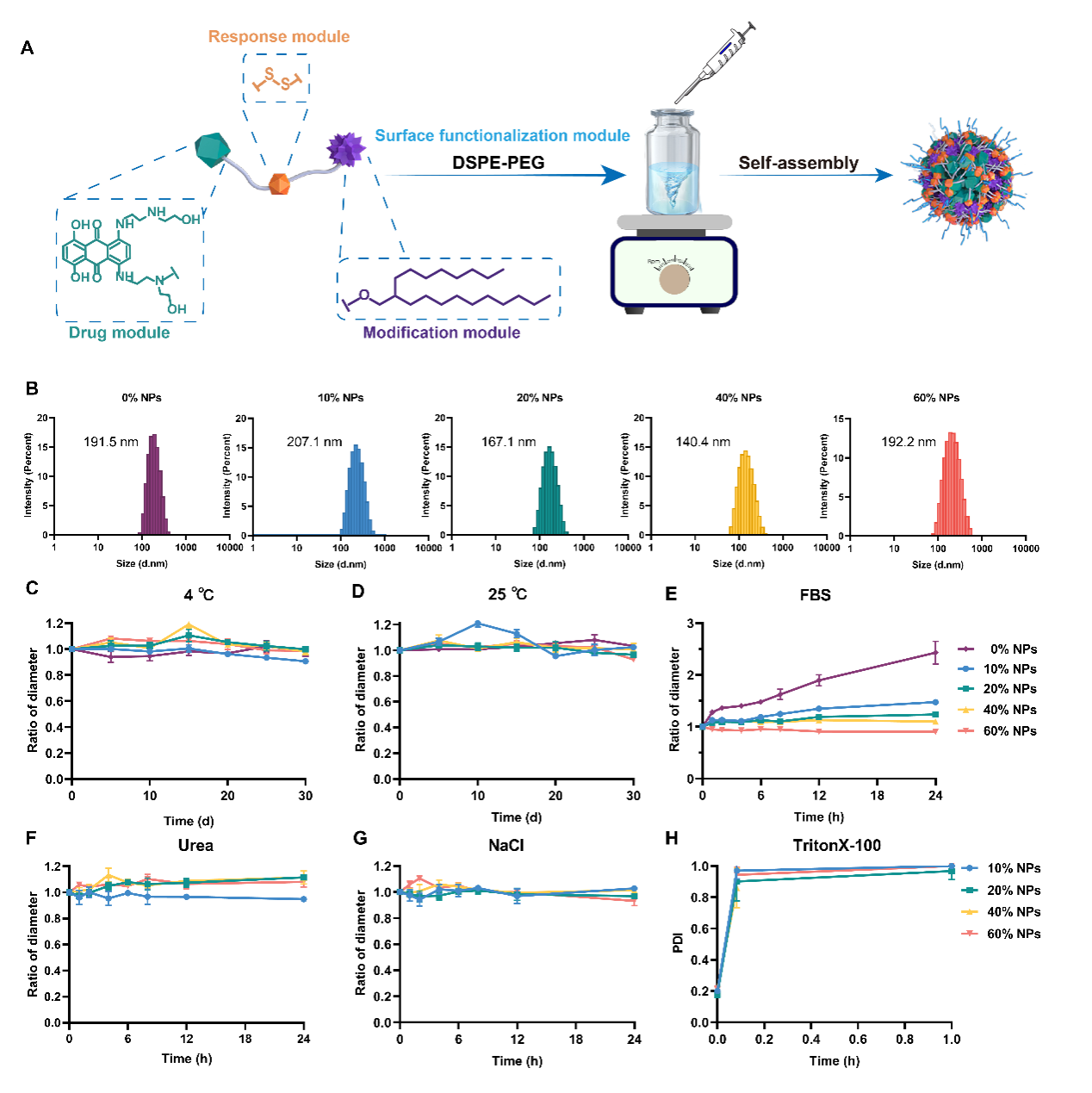
图2. 不同比例表面功能化模块修饰的米托蒽醌前药纳米粒的制剂学研究。
作者接着进行了体外细胞实验。在选择的两种自组装纳米粒(20% NPs 和 40% NPs)中,40% NPs因具有更高的组装稳定性,被细胞摄取的量更多,并能有效释放出母药。因此,其具有更高的细胞毒性,能够造成DNA损伤,最终诱导细胞凋亡(图3)。
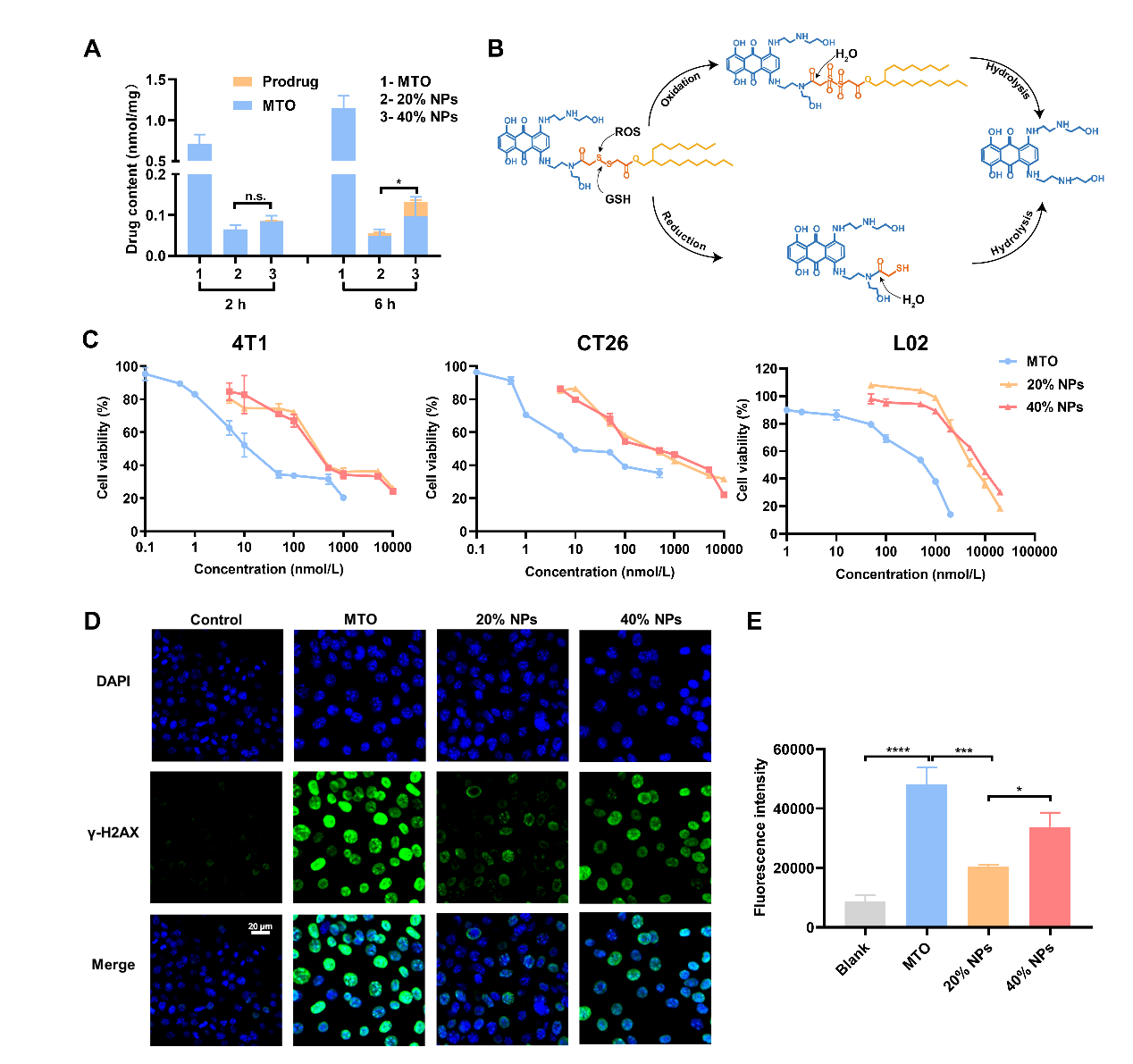
图3. 20% NPs和40% NPs的细胞水平作用机制
接下来,作者对纳米粒的体内命运进行研究。40% NPs因其更小的粒径和更好的组装稳定性,在血液循环中展现了更长的滞留时间和更高的肿瘤蓄积,同时仅有少量米托蒽醌在血液循环过程中从前药中释放来。这有望在保证治疗效果的同时降低与米托蒽醌相关的脱靶毒性。(图4)
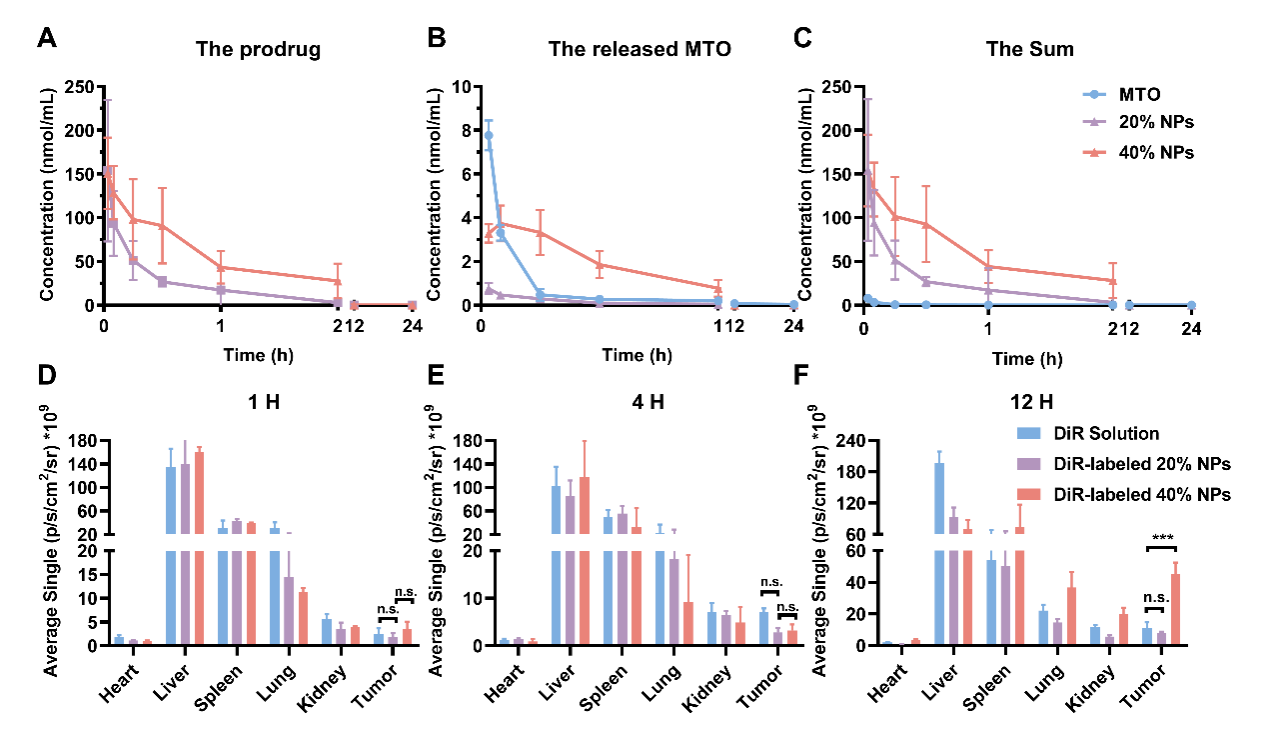
图4. 20% NPs和40% NPs的体内药动学和组织分布。
体内抗肿瘤效果和血常规分析显示(图5),米托蒽醌溶液剂的耐受剂量较低,且存在着严重的毒性。而与米托蒽醌溶液剂相比,40% NPs显著提高了耐受剂量,在保证了治疗效果的同时,提升了米托蒽醌的安全性。

图5. 40% NPs的体内抗肿瘤效果。
我院孙丙军教授为论文的通讯作者,我院2022级硕士生张博闻和2021级博士生李凌霄为共同第一作者,沈阳药科大学为通讯单位。原文链接:https://doi.org/10.1021/acs.nanolett.4c00300
通讯作者

孙丙军,沈阳药科大学教授,博士生导师。先后入选国家高层次青年拔尖人才、辽宁省“兴辽英才计划”青年拔尖人才、全国博士后创新人才支持计划和沈阳市中青年科技创新人才支持计划。主要研究方向为前体药物、前药自组装技术和抗肿瘤高端制剂。以第一作者或通讯作者身份在Nature Communications、Science Advances、Cell Reports Medicine、Advanced Materials、Nano Today、Nano Letters等领域知名期刊发表论文40余篇,其中CNS子刊4篇,ESI高被引论文5篇。申请发明专利33项,申请PCT专利2项,主持专利技术转让2项。主持纵向课题10项,包括国家自然科学基金等国家级项目4项;主持横向课题3项。先后获得辽宁省自然科学学术成果一等奖、二等奖和沈阳市自然科学学术成果一等奖。担任中国抗癌协会纳米肿瘤学专业委员会青年委员,担任中国老年保健协会创新成果转化与应用评价工作委员会委员。担任《Asian Journal of Pharmaceutical Sciences》、《Exploration》、《VIEW》、《Acta Materia Medica》、《沈阳药科大学学报》和《中南药学》的青年编委。连续三年入选美国斯坦福大学公布的全球前2%顶尖科学家榜单(2021-2023)。
第一作者

张博闻,沈阳药科大学药剂学硕士生。以第一作者身份在Nano Letters等期刊发表SCI论文1篇。
第一作者

李凌霄,沈阳药科大学药剂学博士生。研究方向为智能型前药自组装纳米药物递送系统。以第一作者和共同第一作者身份在Advanced Materials等期刊发表SCI论文5篇,申请发明专利10项,获授权专利4项。
辽宁省沈阳市沈河区文化路103号 | 邮编:110016
©2016 沈阳药科大学无涯创新学院 版权所有