无涯创新学院孙丙军教授/姜琪坤特聘教授在前药纳米组装体模块化设计领域取得新进展:定制修饰模块助力小分子前药的合理设计与开发
作者:张睿
日期:2024-06-18
浏览次数:
癌症的治疗仍是世界性疑难问题,小分子前药纳米组装体由于具有制备工艺简单、载药量高、可控的药物释放和无载体毒性等优势而在癌症治疗中展现出巨大的潜力。然而,前药结构的合理设计仍然是一项巨大的挑战。因此,沈阳药科大学无涯创新学院孙丙军教授团队提出了前药的模块化设计概念,将前药划分为药物模块、响应模块和修饰模块,大大提高了药物优化和筛选效率。
在模块化设计中,修饰模块通常由利于前药组装的脂肪族或芳香族侧链构成,修饰模块的结构会影响前药的空间位阻和分子间作用力,进而调节前药纳米组装体的组装、激活和体内命运。本团队前期研究发现,相比于直链脂肪醇,支链脂肪醇可以为前药提供更多的空间位阻,有效打破分子间的有序堆积,促进前药的稳定组装。然而,支链修饰模块在前药纳米组装体中的作用机制和应用价值仍有待深入研究。
近日,沈阳药科大学孙丙军教授和姜琪坤特聘教授在Elsevier出版的纳米领域著名期刊《Nano Today》(IF=17.4)上发表题为“Tailoring modification modules of paclitaxel prodrug nanoassemblies to manipulate efficacy and tolerance”的研究性论文,深入探究了不同碳链长度的支链脂肪醇作为修饰模块对前药纳米组装体组装机制、智能激活等方面的影响以及在调控前药纳米组装体药效学和耐受性方面的作用,为小分子前药的合理设计和有效筛选提供参考。沈阳药科大学无涯创新学院孙丙军教授和姜琪坤特聘教授为通讯作者,无涯创新学院博士后孙一鑫和硕士毕业生王思梦为本文共同第一作者,本工作得到了张天虹教授的大力支持与指导。

在这项研究中(图1),作者以二硫键为桥连设计了不同碳链长度支链脂肪醇修饰的紫杉醇前药纳米组装体(PTX-SS-C16 NPs、PTX-SS-C18 NPs、PTX-SS-C20 NPs、PTX-SS-C24 NPs),系统性考察了支链修饰模块的碳链长度对前药纳米组装体构效关系的影响,解析了不同前药纳米组装体在自组装能力、组装机制、氧化还原智能激活、体内命运、抗肿瘤疗效和耐受性等方面的差异。
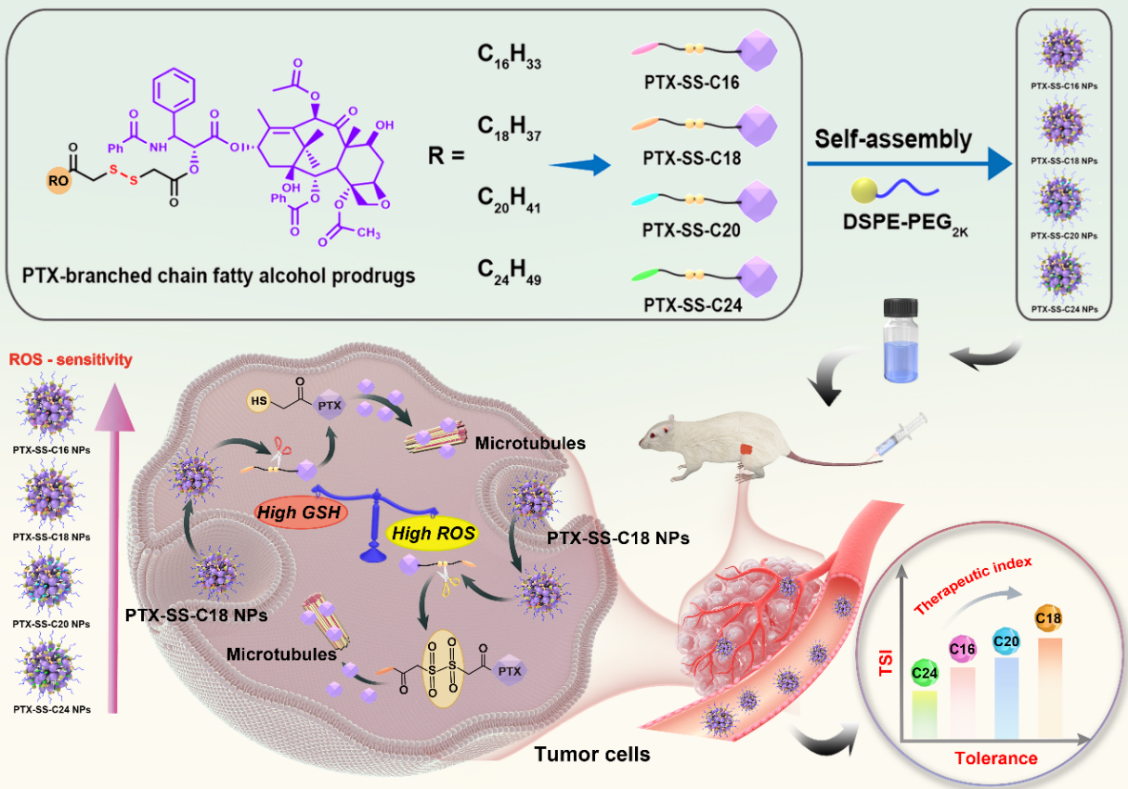
图1. 修饰模块调控紫杉醇前药纳米组装体的抗肿瘤作用和耐受性
作者首先合成了不同碳链长度支链脂肪醇修饰的紫杉醇前药,并利用一步纳米沉淀法构建了前药纳米组装体。结果表明,随着支链修饰模块碳链长度的增加,前药的自组装能力随之增强。通过对组装机制的探索,揭示了疏水作用力是前药组装的主要驱动力,而随着碳链延长,前药的疏水性提高,自组装能力因而增强(图2)。此外,所有前药纳米组装体在4℃和室温条件下可以稳定储存60天,稳定性良好。

图2. 前药纳米组装体的组装机制和组装稳定性
作者接着考察了前药纳米组装体的体外释放行为。如图3所示,修饰模块的碳链长度越短,前药纳米组装体的氧化敏感性越强,而还原敏感性几乎没有差异,其原因可通过对中间体的解析进行解释。在氧化条件下,二硫键被氧化成亲水性亚砜或砜,增加了整个体系的亲水性,促进了紫杉醇临近酯键的水解,而PTX-SS-C24具有最长的脂肪醇链和最强的疏水性,阻碍了水分子对酯键的进攻,因此氧化敏感性较弱。而还原条件下,由于四种前药纳米组装体产生相同的巯基中间体,因此释放速率相似。
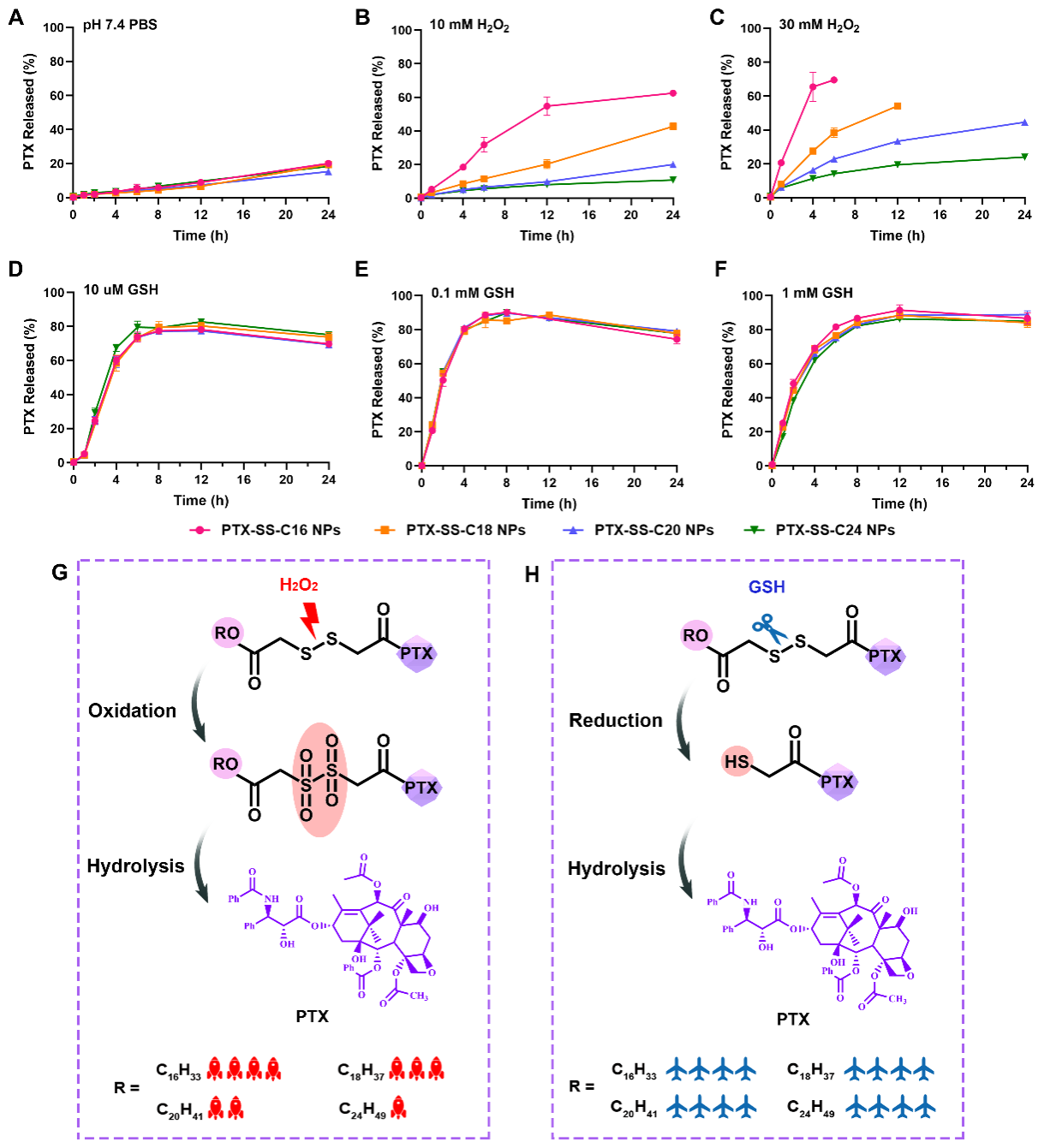
图3. 前药纳米组装体的氧化还原响应释放及释放机制
在细胞水平上,进一步考察了修饰模块结构对前药纳米组装体的影响。发现修饰模块的碳链长度越短,前药纳米组装体能够释放的紫杉醇越多,细胞毒性越强(图4)。此外,修饰模块的碳链长度还会影响前药纳米组装体的肿瘤选择性,进而影响前药纳米组装体的体内抗肿瘤作用和安全性。其中,PTX-SS-C18 NPs的肿瘤选择性最好,而PTX-SS-C24 NPs的肿瘤选择性最差。可能是由于PTX-SS-C18 NPs具有适当的碳链长度和氧化还原敏感性,最终影响了前药纳米组装体对肿瘤细胞和正常细胞的细胞毒性作用。
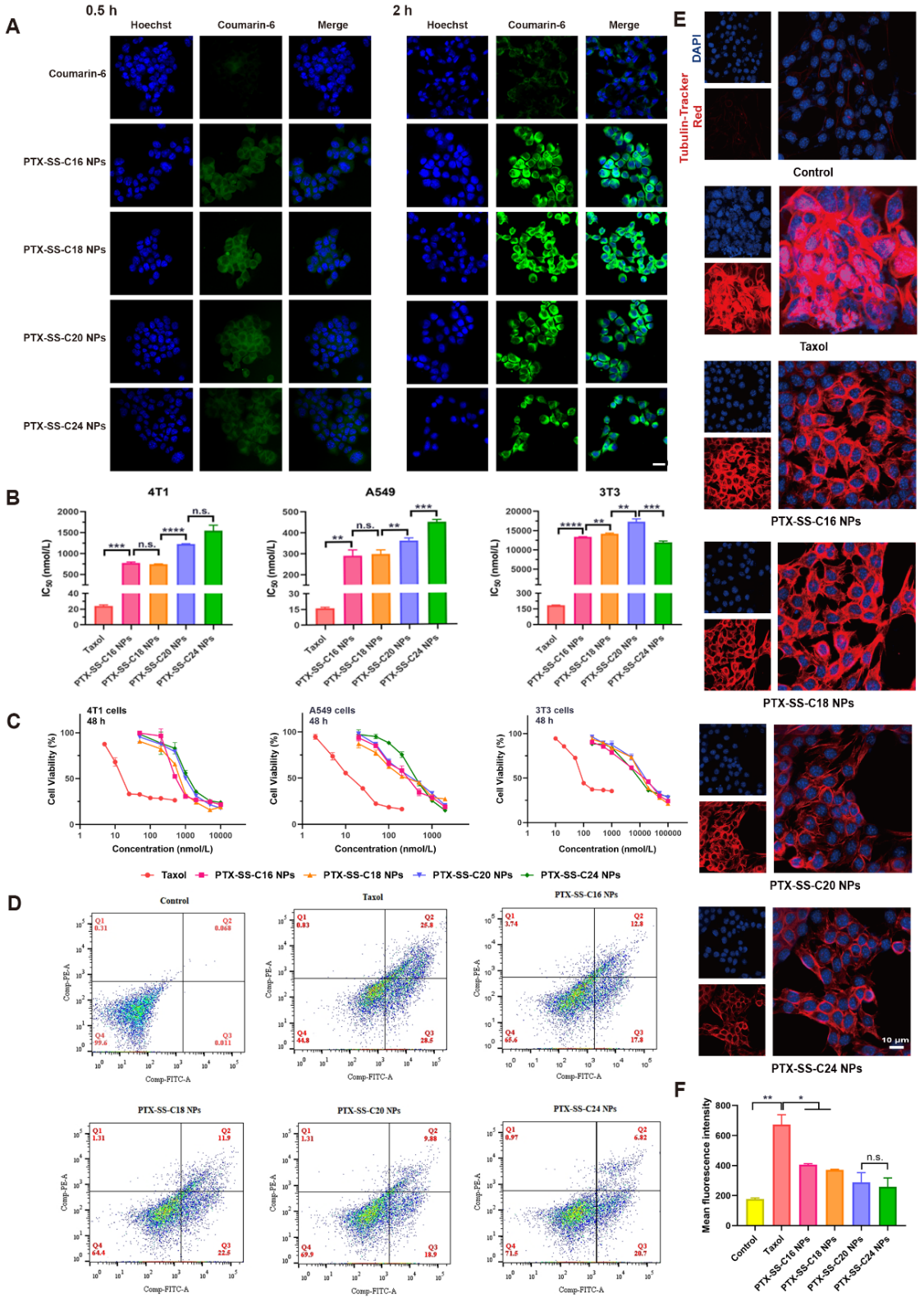
图4. 前药纳米组装体的细胞水平研究
接下来,作者对前药纳米组装体的药动学行为进行了考察(图5)。结果发现,随着修饰模块碳链长度的延长,前药纳米组装体的血药浓度-时间曲线下面积(AUC)随之增加,显著改善了紫杉醇的药代动力学行为。

图5. 前药纳米组装体的药动学研究
作者接着考察了不同前药纳米组装体的抗肿瘤作用和安全性(图6)。在低剂量(10 mg/kg)下,由于PTX-SS-C18 NPs具有较强的氧化还原释药能力和较高的肿瘤选择性,因此,显示出优越的抗肿瘤效果和安全性,其抗肿瘤效果与市售的Abraxane(白蛋白结合型紫杉醇)相当。在高剂量(45 mg/kg)下,前药纳米组装体的抗肿瘤效果随着碳链长度的增加有降低的趋势。其中,PTX-SS-C16 NPs、PTX-SSC18 NPs和PTX-SS-C20 NPs无论在抗肿瘤作用还是在安全性方面均优于PTX-SS-C24 NPs。
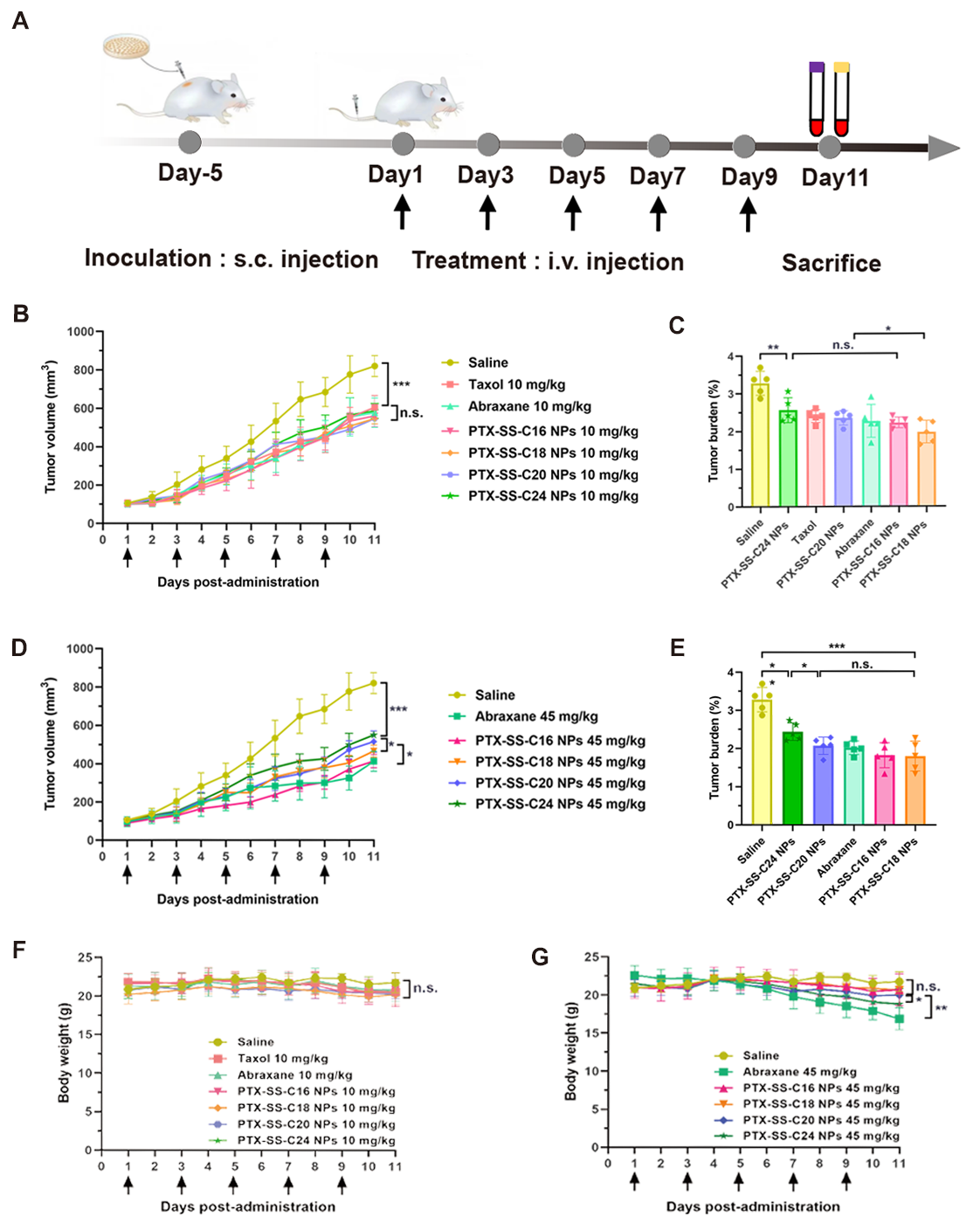
图6. 前药纳米组装体的抗肿瘤作用和安全性评价
综上,通过深入探究修饰模块对前药纳米组装体构效关系的影响能够为前药的合理设计提供理论基础。这种定制纳米医学策略有望助力具有最佳疗效的前药纳米组装体的高效筛选与开发。
原文链接:
https://doi.org/10.1016/j.nantod.2024.102275
通讯作者

孙丙军,沈阳药科大学教授,博士生导师。先后入选国家高层次青年拔尖人才、辽宁省“兴辽英才计划”青年拔尖人才、全国博士后创新人才支持计划和沈阳市中青年科技创新人才支持计划。主要研究方向为前体药物、前药自组装技术和抗肿瘤高端制剂。以第一作者或通讯作者身份在Nature Communications、Science Advances、Cell Reports Medicine、Advanced Materials、Nano Today、Nano Letters等领域知名期刊发表论文40余篇,其中CNS子刊4篇,ESI高被引论文5篇。申请发明专利33项,申请PCT专利2项,主持专利技术转让2项。主持纵向课题10项,包括国家自然科学基金等国家级项目4项;主持横向课题3项。先后获得辽宁省自然科学学术成果一等奖、二等奖和沈阳市自然科学学术成果一等奖。担任中国抗癌协会纳米肿瘤学专业委员会青年委员,担任中国老年保健协会创新成果转化与应用评价工作委员会委员。担任《Asian Journal of Pharmaceutical Sciences》、《Exploration》、《VIEW》、《Acta Materia Medica》、《沈阳药科大学学报》和《中南药学》的青年编委。连续三年入选美国斯坦福大学公布的全球前2%顶尖科学家榜单(2021-2023)。

姜琪坤,药剂学博士,沈阳药科大学无涯创新学院特聘教授。研究方向为基于前药技术的改良型新药的研究;作为课题负责人主持纵向和横向课题7项;以第一作者或通讯作者身份在Nano Today、Acta Pharmaceutica Sinica B、Journal of Controlled Release、Nano Research和Journal of Medicinal Chemistry等国际权威期刊发表SCI学术论文20余篇,入选ESI高被引论文1篇;申请中国专利9项,PCT专利2项,其中2项专利已转让,具有良好的经济效益和社会效益;获得沈阳市自然科学学术成果二等奖(排名第1)和全国博士后创新创业大赛优胜奖(排名第2)。担任《Asian Journal of Pharmaceutical Sciences》、《Acta Materia Medica》和《Asian Journal of Traditional Medicines》的青年编委以及《Current Drug Delivery》的编委。
第一作者

孙一鑫,中共党员,现为沈阳药科大学在站师资博士后。以第一作者身份在Nano Today, Acta Pharmaceutica Sinica B,Acta Biomaterialia,等期刊发表SCI论文5篇,其中,ESI高被引论文1篇。申请专利9项,获授权专利1项。参与国家科技部重点研发计划1项,主持包括中国博士后科学基金特别资助(站前)项目等共4项。获得第一届辽宁省博士后创新创业大赛三等奖。担任《Cancer Advances》和《Asian Journal of Traditional Medicines》期刊青年编委。主要研究方向为前体药物和前药自组装纳米递送系统的模块化设计。

王思梦,沈阳药科大学药物分析学硕士研究生。以第一作者身份在Nano Today发表SCI论文1篇。
辽宁省沈阳市沈河区文化路103号 | 邮编:110016
©2016 沈阳药科大学无涯创新学院 版权所有