无涯创新学院罗聪/张申武团队在小分子纳米组装领域取得新进展
作者:张睿
日期:2024-08-20
浏览次数:
恶性肿瘤是全球面临的一个巨大健康挑战。肿瘤代谢异常是肿瘤细胞的一个标志性特征,与肿瘤的发生、发展有着错综复杂的关系。鉴于正常细胞和肿瘤细胞之间存在巨大的代谢差异,以干扰肿瘤能量代谢为中心的诱导饥饿治疗策略作为新兴的抗癌模式受到了广泛关注。然而,厌氧糖酵解和线粒体氧化磷酸化之间固有的互补性,导致诱导肿瘤能量耗竭的治疗策略的有效性面临着肿瘤细胞中普遍存在的双重能量供应模式的相互补偿机制的实质性障碍。随着纳米技术的不断发展,无载体纳米药物递药系统在药物递送方面显示出潜力。其中,无载体共组装纳米递送系统是由两种或两种以上药物共组装形成的不依赖载体材料的新型纳米制剂,具有制备简单、药物共载效率高、药代动力学匹配、肿瘤特异性积累和药物同步释放等多重优势。此外,分子间相互作用驱动的无载体纳米组装体的形成赋予了出色的同步递药特性。在无载体纳米共组装体表面修饰少量的DSPE-SS-PEG2K赋予纳米组装体还原响应释药特性,为高效低毒的抗肿瘤药物联合递送提供优良的技术平台。
近日,沈阳药科大学无涯创新学院罗聪教授/张申武教授在Nano Today杂志(IF = 13.2)在线发表题为“A molecularly tailored closed-loop tumor cell energy nanodepleter for cancer starvation therapy”的研究性论文,报道了一种糖酵解/线粒体氧化磷酸化双向闭环能量耗竭诱导肿瘤消融的纳米药物递送策略。
在这项研究中,作者提出了一种糖酵解/线粒体双向闭环能量耗竭策略。首次设计并合成了一种由三苯基膦(TPP)和内源性无细胞毒性的花生四烯酸(AA)组成的功能偶联物(TPP-AA),其在线粒体的高活性氧(ROS)水平过氧化AA后引发肿瘤线粒体特异性氧化损伤。值得注意的是,与AA相比,TPP-AA不仅对肿瘤细胞的细胞毒性提高了50倍以上,而且在药理学上可达到的浓度下,对正常细胞的细胞毒性可以忽略不计。TPP-AA的细胞毒性选择性应归因于正常细胞和肿瘤细胞之间线粒体膜电位的巨大差异,使其成为一种具有良好安全性的氧化磷酸化抑制剂。更重要的是,TPP-AA表现出与JQ1(一种糖酵解抑制剂)以不同的摩尔比自发共组装成无载体纳米药物的倾向。此外,将TPP-AA制备成纳米耗竭器可以避免TPP的阳离子毒性。经过优化和氧化还原响应的DSPE-SS-PEG2K修饰,以1:3的最佳摩尔比(TPP-AA/JQ1)制备了无载体的双向纳米耗竭器。在肿瘤细胞高谷胱甘肽(GSH)水平下,释放出TPP-AA和JQ1。随后,TPP-AA通过引发线粒体功能障碍阻断线粒体氧化磷酸化。同时,JQ1通过下调肿瘤细胞中c-Myc抑制糖酵解途径。最后,纳米耗竭器通过肿瘤特异性糖酵解/线粒体双向能量消耗,在多种荷瘤小鼠模型中显著抑制肿瘤生长。
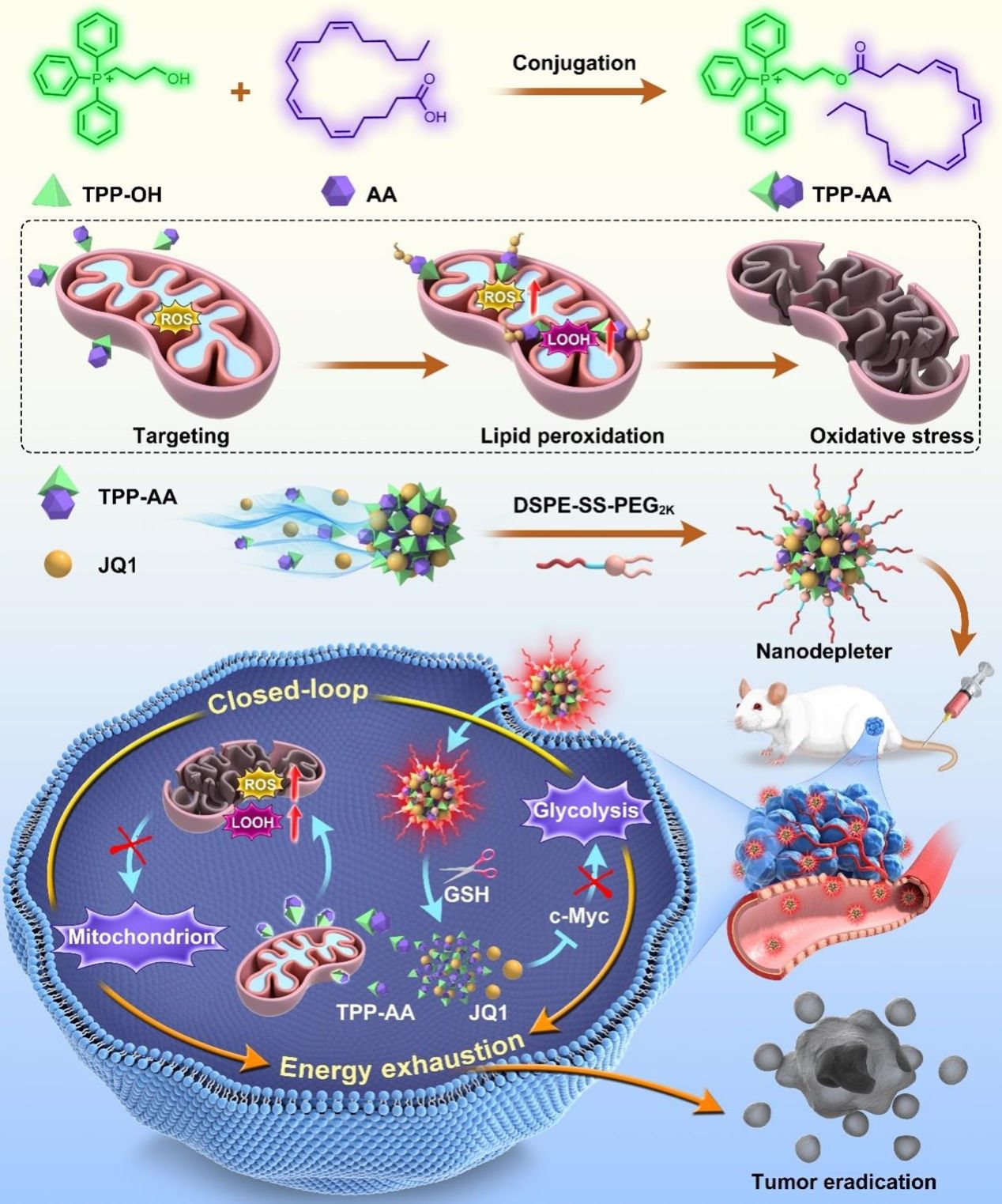
图1. 分子定制闭环肿瘤细胞能量纳米耗竭器用于癌症饥饿治疗。
首先,作者设计并合成了一种新的线粒体氧化磷酸化抑制剂(TPP-AA),并研究了TPP-AA对肿瘤细胞和正常细胞的细胞毒性(图2)。结果表明,与AA相比,TPP-AA不仅对肿瘤细胞的细胞毒性提高了50倍以上,而且在药理学上可达到的浓度下,对正常细胞的细胞毒性可以忽略不计,显示出出色的治疗选择性。此外,作者研究了TPP-AA和AA对4T1细胞的线粒体影响。采用MitoPeDPP测定线粒体脂质过氧化程度,结果表明,与AA处理后的细胞相比,TPP-AA处理的4T1细胞显示出更强的绿色荧光,这表明TPP-AA引起了显著的线粒体脂质过氧化。此外,利用含JC-1的线粒体膜电位测定试剂盒,研究了经AA或TPP-AA处理的4T1细胞线粒体膜电位的变化。升高的线粒体膜电位诱导JC-1在线粒体基质内的积累,发出红色荧光。相反,JC-1在线粒体膜电位低的情况下保持单体状态,产生绿色荧光。与AA处理的细胞相比,TPP-AA处理的4T1细胞荧光发生了从红色到绿色的明显改变,这进一步表明TPP-AA能有效靶向线粒体,诱导线粒体功能性障碍。综上所述,这些结果共同说明,TPP-AA通过TPP驱动的线粒体靶向效应和外源补充多不饱和脂肪酸AA有效地引发线粒体功能性障碍,且AA在线粒体中容易被氧化成LPOs。
此外,作者以寡霉素为阳性对照,进一步验证了TPP-AA对氧化磷酸化的抑制作用。结果表明,TPP-AA对氧化磷酸化具有浓度依赖性的抑制作用,这与寡霉素的作用相同。耗氧率的实验结果进一步证实了这一结论。人们普遍认为,除了氧化磷酸化外,肿瘤还依赖糖酵解来提供能量。同时,作者证实了JQ1的糖酵解抑制能力。寡霉素处理后,细胞糖酵解增强,而JQ1处理显著降低糖酵解水平,表明JQ1具有抑制糖酵解的能力。通过使用寡霉素抑制氧化磷酸化途径ATP合成,将评估扩展到代谢途径转变。测定细胞内总ATP含量,代谢途径转移的指标为糖酵解产生的ATP和线粒体氧化磷酸化产生的ATP。结果表明,经糖酵解抑制剂JQ1处理后,4T1细胞的代谢途径由糖酵解转向氧化磷酸化。鉴于厌氧糖酵解和线粒体氧化磷酸化之间固有的互补性,单独抑制或干扰这两种能量代谢模式中的任何一种在癌症饥饿治疗中被证明是低效的。因此,作者推测TPP-AA的肿瘤特异性线粒体功能障碍能力和JQ1的糖酵解抑制能力使它们在癌症饥饿联合治疗中极具潜力。
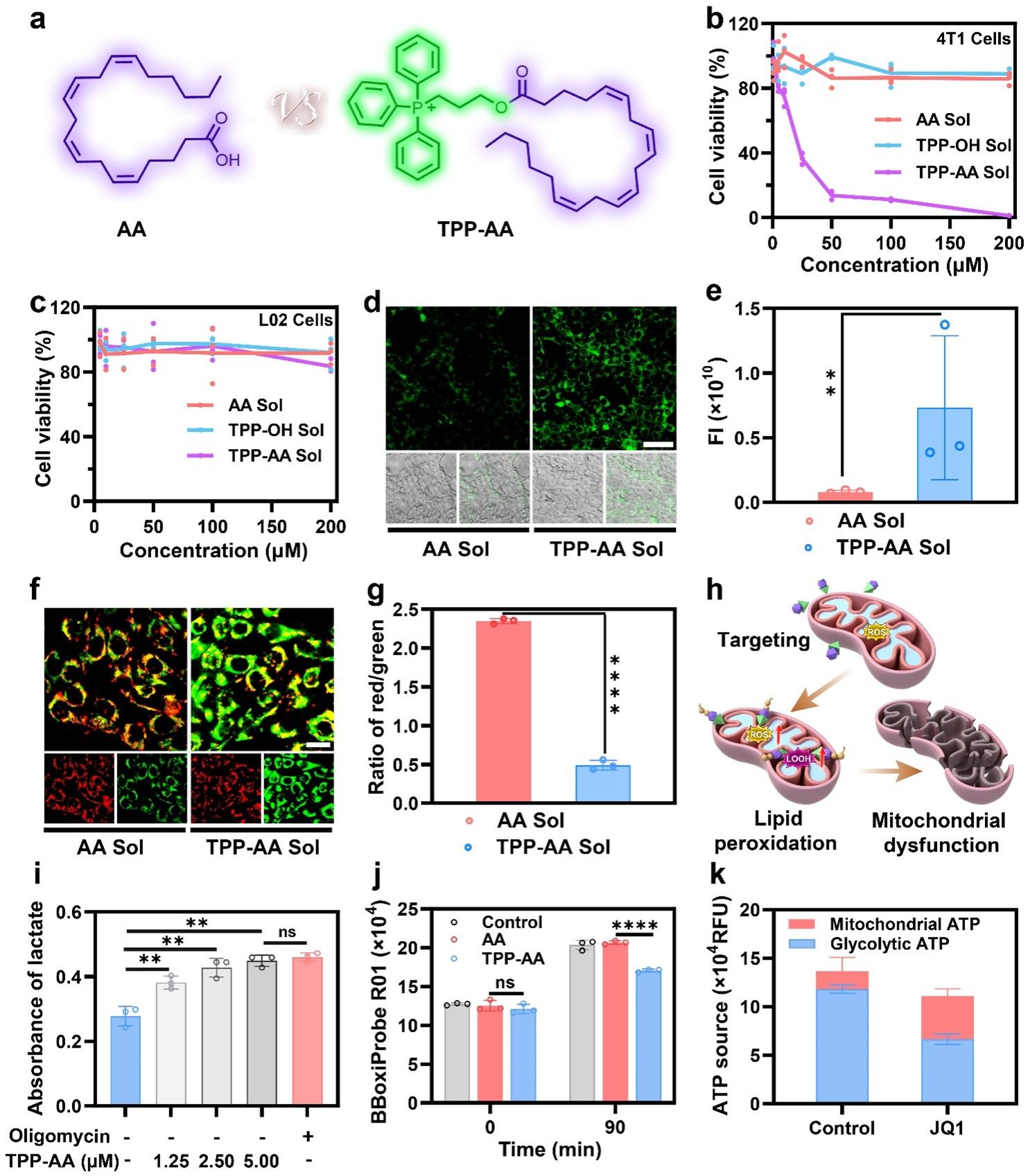
图2. 一种新型肿瘤特异性线粒体抑制剂的合理设计。
采用一步纳米沉淀法,TPP-AA和JQ1能够在没有任何载体材料的帮助下,以1:5至5:1的摩尔比进行共组装(图3)。综合考虑组装性能和协同细胞毒性,以TPP-AA/JQ1的摩尔比为1:3制备双向能量耗竭器。为了改善药代动力学和促进肿瘤特异性药物释放,采用二硫键桥接DSPE-SS-PEG2K作为表面修饰剂制备了还原响应型双向能量纳米耗竭器(TAJS NAs)。此外,以DSPE-PEG2K为修饰剂制备不具还原响应性的对照组(TAJP NAs)。结果表明,TAJP NAs和TAJS NAs具有非常相似的粒径分布(~100 nm)、Zeta电位和形态。此外,TAJP NAs和TAJS NAs在PBS(pH 7.4)、胎牛血清和血浆中均具有良好的稳定性。同样,4℃保存一周或冻干前后,粒径也没有明显变化。这些结果表明TAJP NAs和TAJS NAs具有优异的稳定性。随后,利用计算机分子对接技术及作用力破坏实验探讨了驱动TPP-AA/JQ1共组装的分子间作用力。结果表明,疏水相互作用、π-π堆叠、氢键和静电相互作用共同驱动了TAJ NAs的形成。此外,为了评估氧化还原刺激引发的TAJS NAs的解体行为,在二硫苏糖醇(DTT)存在下测定NAs(TAJP NAs和TAJS NAs)的粒径变化。结果表明,DSPE-SS-PEG2K修饰的TAJS NAs在氧化还原刺激下具有良好的解体特性。
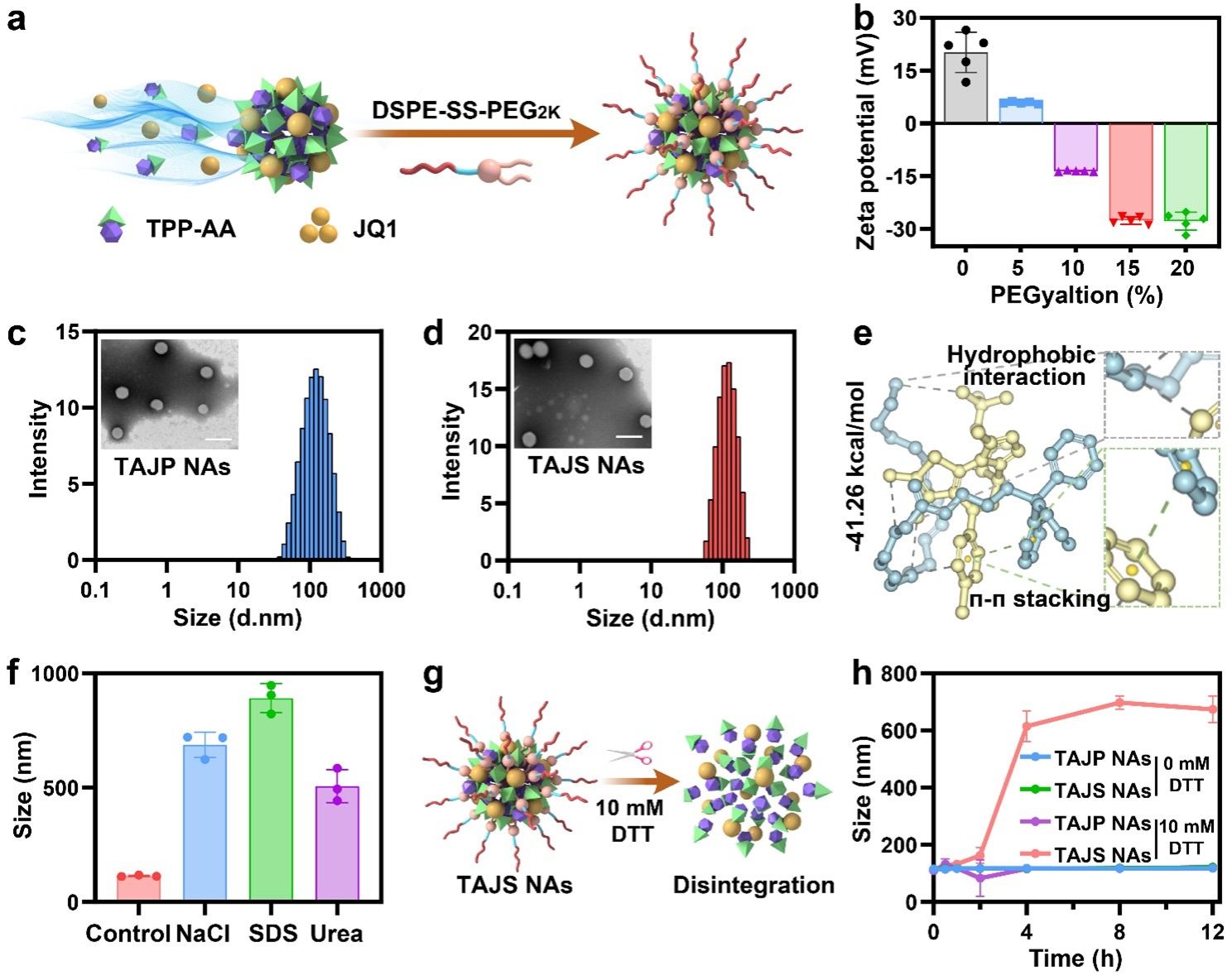
图3. 双阻断纳米耗竭器的合理设计。
接下来,考察了Cy7标记的纳米耗竭器在4T1细胞中的摄取行为(图4)。实验结果表明,纳米耗竭器的形成提高了细胞摄取效率并具有时间依赖性。并且,TAJS NAs在多种细胞模型中均表现出最强的细胞毒性(图4)。随后,作者通过测定4T1细胞中ROS、线粒体脂质过氧化、c-Myc、乳酸、乳酸脱氢酶(LDH)、ATP的水平,评估两者发挥协同作用的机制(图4)。结果表明,含TPP-AA的组别处理4T1细胞后,细胞内ROS积累明显增强,这可能是由于TPP-AA诱导肿瘤细胞线粒体膜脂质过氧化所致,所有含JQ1的组别均下调了细胞c-Myc水平,证实了JQ1对糖酵解途径的抑制作用。此外,JQ1介导的糖酵解抑制导致LDH和乳酸外排显著降低。由于TPP-AA和JQ1对肿瘤细胞糖酵解/线粒体能量轴的协同抑制,TPP-AA和JQ1的结合导致细胞ATP水平显著降低,其中TAJS NAs表现出最明显的效果。这些结果证实,TPP-AA与JQ1联合使用确实存在糖酵解/线粒体双阻断能量耗竭的协同机制。
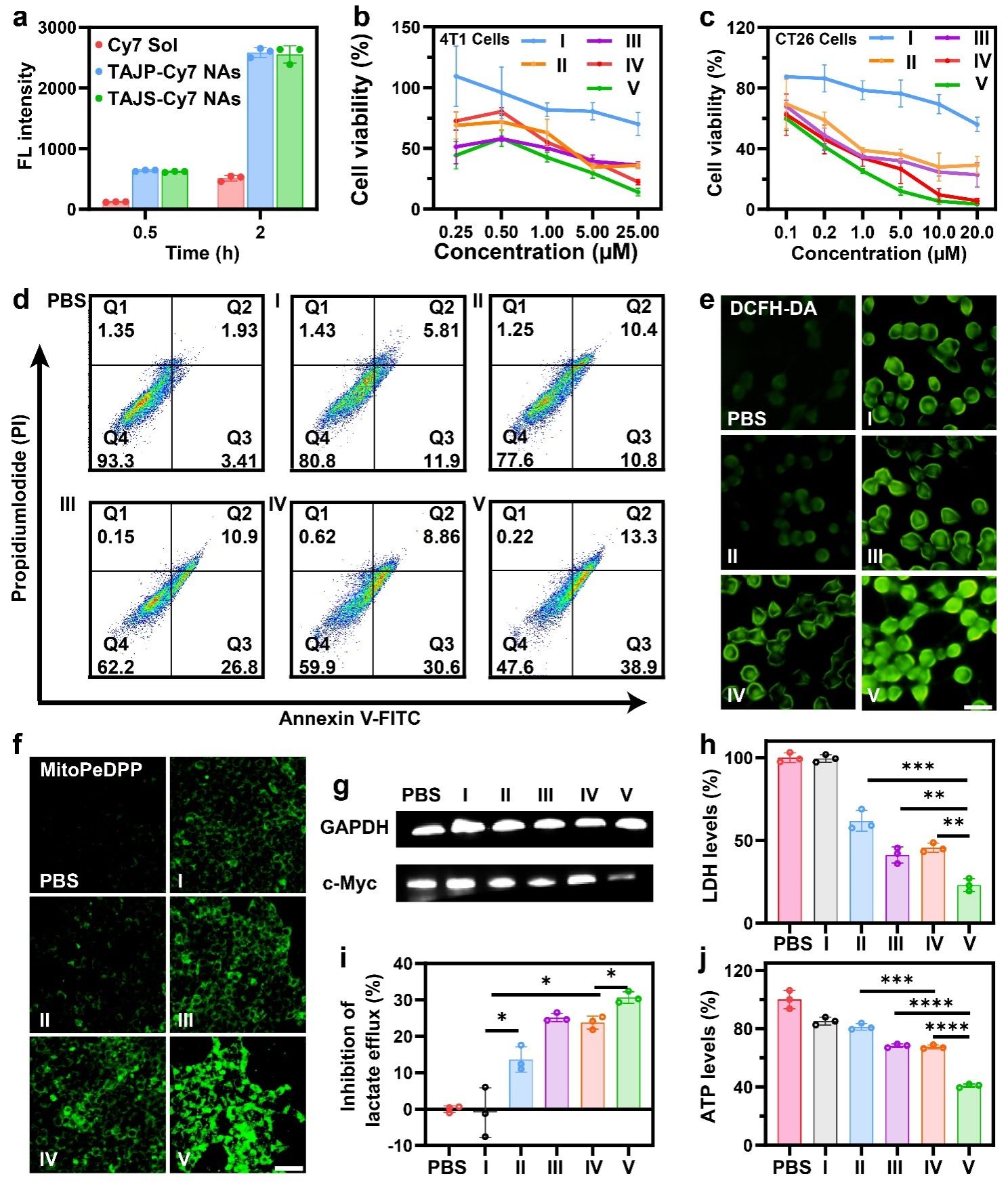
图4. 纳米耗竭器的细胞摄取、协同细胞毒性和机制探究。
接下来,作者考察了纳米耗竭器的体内药动学行为(图5)。结果显示,纳米耗竭器显著延长了血液循环时间,这有利于其在肿瘤部位的高效蓄积。随后,作者建立了4T1荷瘤小鼠模型,通过体内分布实验探究了纳米耗竭器在小鼠体内的分布情况(图5)。结果表明,在相同条件下,TAJP-Cy7 NAs和TAJS-Cy7 NAs在肿瘤中显示的荧光信号都比Cy7 Sol高得多。离体荧光成像结果表明,TAJP-Cy7 NAs和TAJS-Cy7 NAs在注射后8 h的肿瘤积累效率均高于注射后6 h的Cy7 Sol。这些结果表明,纳米耗竭器可显著改善其药代动力学和生物分布,从而提高抗肿瘤效果。
随后,作者在4T1肿瘤荷瘤小鼠模型中考察了协同抗肿瘤活性(图5)。结果表明,TPP-AA溶液剂和JQ1溶液剂对肿瘤生长抑制作用有限,这可能与体内消除快、肿瘤蓄积少、单药治疗部分能量阻滞有关。TPP-AA与JQ1(TAJ Sol)的混合溶液比TPP-AA Sol或JQ1 Sol具有更强的抗肿瘤活性,表明两者具有协同作用。TAJS NAs在整个治疗方案中具有最有效的抑制肿瘤生长的能力。最后,对其抗肿瘤作用的体内机制进行了评估,检测不同处理后肿瘤组织中c-Myc、乳酸、LDH、ATP水平。结果表明,TAJS NAs组c-Myc、LDH、乳酸外排和ATP生成显著降低,与体外实验数据一致(图4)。这些结果进一步证实了TPP-AA和JQ1的组合通过糖酵解/线粒体双重阻断实现了能量耗竭驱动的闭环肿瘤根除。
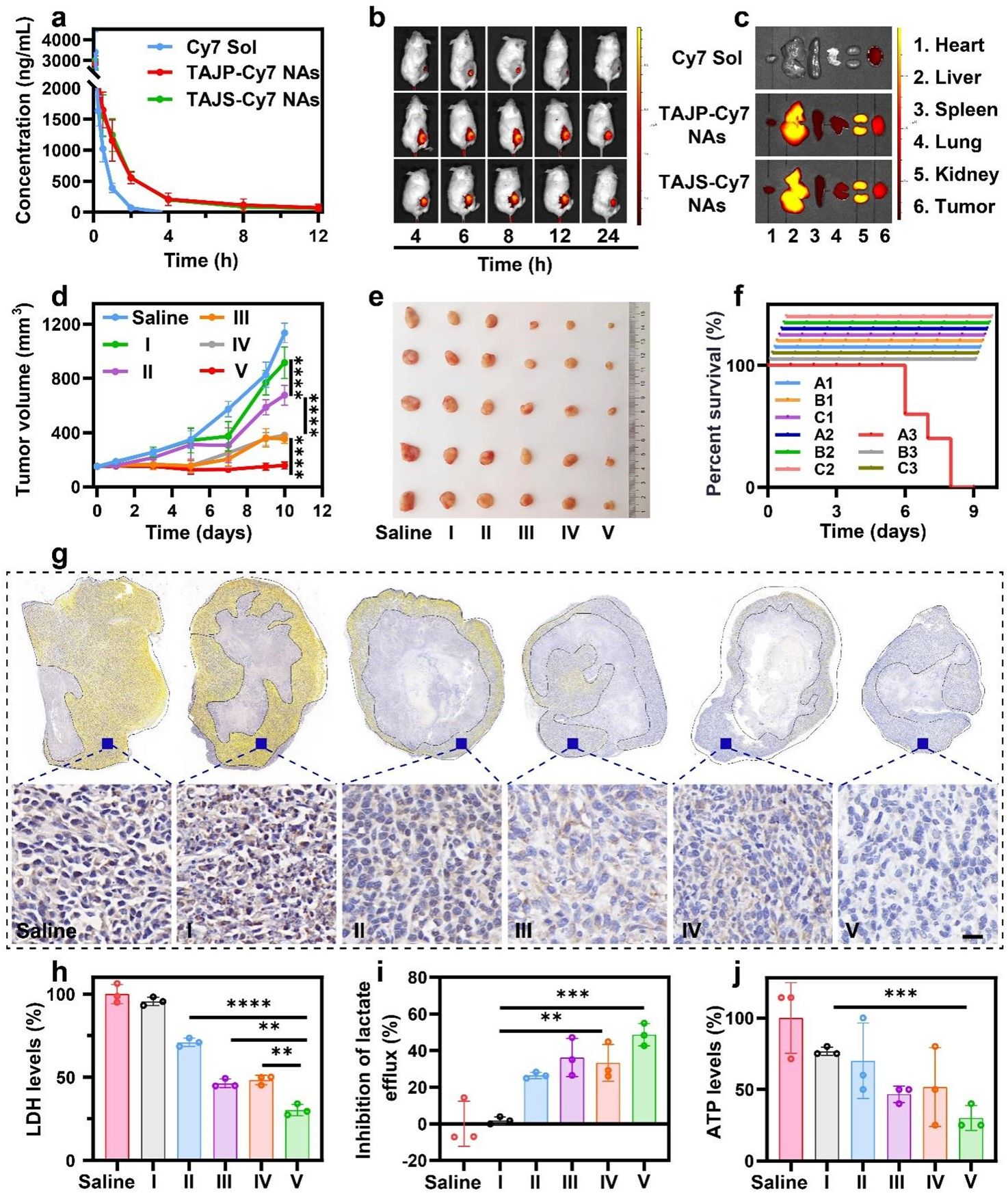
图5. 纳米耗竭器的体内药动学、体内分布及体内抗肿瘤活性的探究。
最后,作者对CT26荷瘤小鼠进行了不同组别的制剂处理(图6)。结果表明,与TPP-AA Sol和JQ1 Sol单独单药治疗相比,联合用药组(TAJ Sol、TAJP NAs和TAJS NAs)的抗肿瘤效果明显增强,这与4T1荷瘤BALB/c小鼠的结果相似。其中,TAJS NAs的肿瘤抑制效果仍然是最强的,治疗安全性良好。此外,TAJS NAs治疗后明显下调肿瘤中LDH、乳酸和ATP的产生水平。综合来看,作者基于一种高效安全的肿瘤特异性线粒体抑制剂(TPP-AA)的发现构建的双向阻断纳米耗竭器是一种有前景的纳米药物,用于多种肿瘤模型的癌症饥饿治疗。

图6. 纳米耗竭器在CT26荷瘤小鼠中的抗肿瘤作用。
我院罗聪教授为本文通讯作者,2023级博士生孙新新和张申武教授为本文共同第一作者,沈阳药科大学为第一通讯单位。原文链接:https://doi.org/10.1016/j.nantod.2024.102374.
辽宁省沈阳市沈河区文化路103号 | 邮编:110016
©2016 沈阳药科大学无涯创新学院 版权所有