无涯创新学院何仲贵/张申武团队在小分子纳米组装领域取得新进展
作者:张睿
日期:2024-08-21
浏览次数:
恶性肿瘤持续威胁人类的生命健康,目前临床治疗手段虽多,但疗效常不尽人意。近年来,铁死亡作为一种新型细胞死亡方式,为癌症治疗开辟了新路径。在细胞铁死亡过程中,谷胱甘肽过氧化物酶4(GPX4)扮演着核心角色。GPX4的抑制会引发细胞内脂质过氧化累积,诱导细胞铁死亡。然而,肿瘤细胞膜上的高饱和度脂质为其提供保护,会阻碍GPX4抑制剂诱导的细胞膜脂质过氧化过程。脂肪酸合酶(FASN)是调节脂质合成的关键酶,抑制FASN能够促进膜上多不饱和脂肪酸(PUFAs)的累积,降低癌细胞对高饱和度膜脂的依赖,从而削弱其对铁死亡的抵抗性。质膜破裂是铁死亡的晚期事件,因此,将GPX4抑制剂与脂质代谢调节策略相结合,有望攻克铁死亡过程中的“最后一道防线”,与GPX4抑制剂发挥高效的协同抗肿瘤作用。然而,大多数GPX4抑制剂水溶性低,使其与FASN抑制剂等脂质调节药物有效共同递送变得困难。随着生物技术和纳米医学的进步,基于分子工程构建的小分子纳米组装策略备受关注。小分子纳米组装体(NAs)与传统纳米制剂相比具有明显的优势。首先,它消除了传统药物载体的需求,增强了药物装载量,并减轻了潜在的毒性和免疫反应。其次,小分子NAs可以通过分子工程策略整合多种功能,例如实现视觉监测,并精确控制生物相容性和生物降解性。此外,这种技术提供的独特设计和精确控制为小分子药物的协同输送提供了灵活、高效和可控的解决方案,为药物输送领域的重大突破带来了巨大的希望。
近日,沈阳药科大学无涯创新学院何仲贵教授/张申武教授在Chemical Engineering Journal杂志(IF = 13.3)在线发表题为“Molecularly engineering a lipid nanoregulator destroying the last defense of ferroptosis in breast cancer therapy”的研究性论文,报道了一种通过调节膜脂饱和度放大铁死亡驱动的抗肿瘤纳米药物递送策略。

在这项研究中,作者提出了一种创新策略,旨在通过拆除铁死亡过程中的“最后一道防线(膜脂质屏障)”来放大铁死亡驱动的抗肿瘤作用。作者通过纳米组装技术和分子工程设计,构建了GPX4抑制剂(RSL3)和FASN抑制剂(Orlistat)的二元脂质纳米调节器(图1)。在组装过程中,RSL3和Orlistat可以自发组装成均匀的纳米组装体(RO NAs),进一步使用还原响应DSPE-SS-PEG 2K对RO NAs进行修饰,增强了纳米粒的稳定性并实现肿瘤特异性药物释放。值得注意的是,Orlistat本身是一个无细胞毒性的小分子化合物,通过抑制 FASN 来调节细胞膜脂质组成,促进多不饱和脂肪酸(PUFAs)的合成和积累。实验结果表明,与单独使用RSL3相比,无细胞毒性的Orlistat显著增强了 RSL3 对肿瘤细胞的细胞毒性,引发了强烈的铁死亡。最终,纳米调节器通过Orlistat和 RSL3 的联合诱导引发了剧烈的脂质过氧化风暴,成功瓦解了对抗铁死亡的“最后一道防线”,在 4T1 肿瘤小鼠中显示出良好的治疗效果。这项研究为开发铁死亡驱动的抗肿瘤纳米疗法提供了一个有效的范例,展示了分子工程在推进癌症治疗方式方面的潜力。

图1.脂质纳米调节器用于增敏铁死亡。
首先,作者验证无细胞毒性的Orlistat增强了RSL3对肿瘤细胞4T1的细胞毒性。采用一步纳米沉淀法,RSL3和Orlistat能够在没有任何载体材料的帮助下,以1:5至1:10的摩尔比进行共组装。综合考虑组装性能和细胞毒性,以RSL3/Orlistat的摩尔比为1:5制备脂质纳米调节器,并在其表面修饰具有氧化还原响应的DSPE-SS-PEG 2K。脂质纳米调节器(sp-RO NAs)具有均一的粒径并在透射电镜下呈现出球形结构。sp-RO NAs在PBS(pH 7.4)、胎牛血清中均具有良好的稳定性。并且,冻干前后,粒径也没有明显变化。随后,利用计算机分子对接技术及作用力破坏实验探讨了驱动RO NAs共组装的分子间作用力。结果表明,上诉共组装过程主要由疏水作用力驱动。此外,为了评估还原刺激引发的sp-RO NAs的解体行为,在二硫苏糖醇(DTT)存在下测定NAs(RO NAs和sp-RO NAs)的粒径变化,并通过透射电镜拍摄到sp-RO NAs经DTT孵育后的形态变化。结果表明,DSPE-SS-PEG2K修饰的sp-RO NAs具有还原反应性,确保其抗肿瘤作用和安全性(图2)。
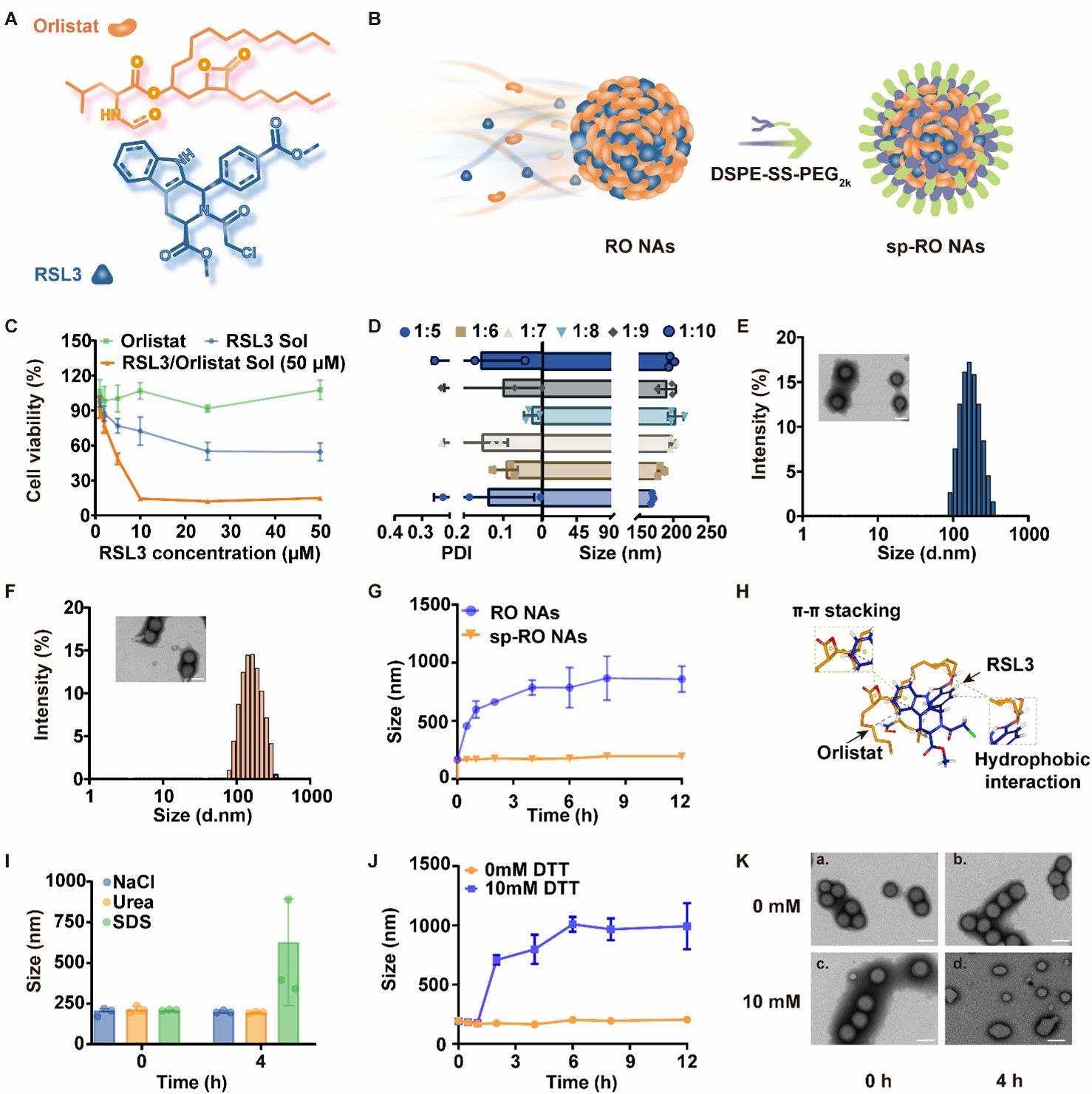
图2.脂质纳米调节器的制备与表征。
接下来,考察了Cy7标记的脂质纳米调节器在4T1乳腺癌细胞中的摄取行为。实验结果表明,脂质纳米调节器的形成提高了细胞摄取效率并具有时间依赖性。并且,sp-RO NAs在多种细胞模型中均表现出最强的细胞毒性。为了进一步评估制剂的安全性,采用了小鼠成纤维细胞系 3T3 细胞进行细胞毒性试验,实验结果表明该制剂在抗肿瘤功效和安全性之间具有良好平衡(图3)。
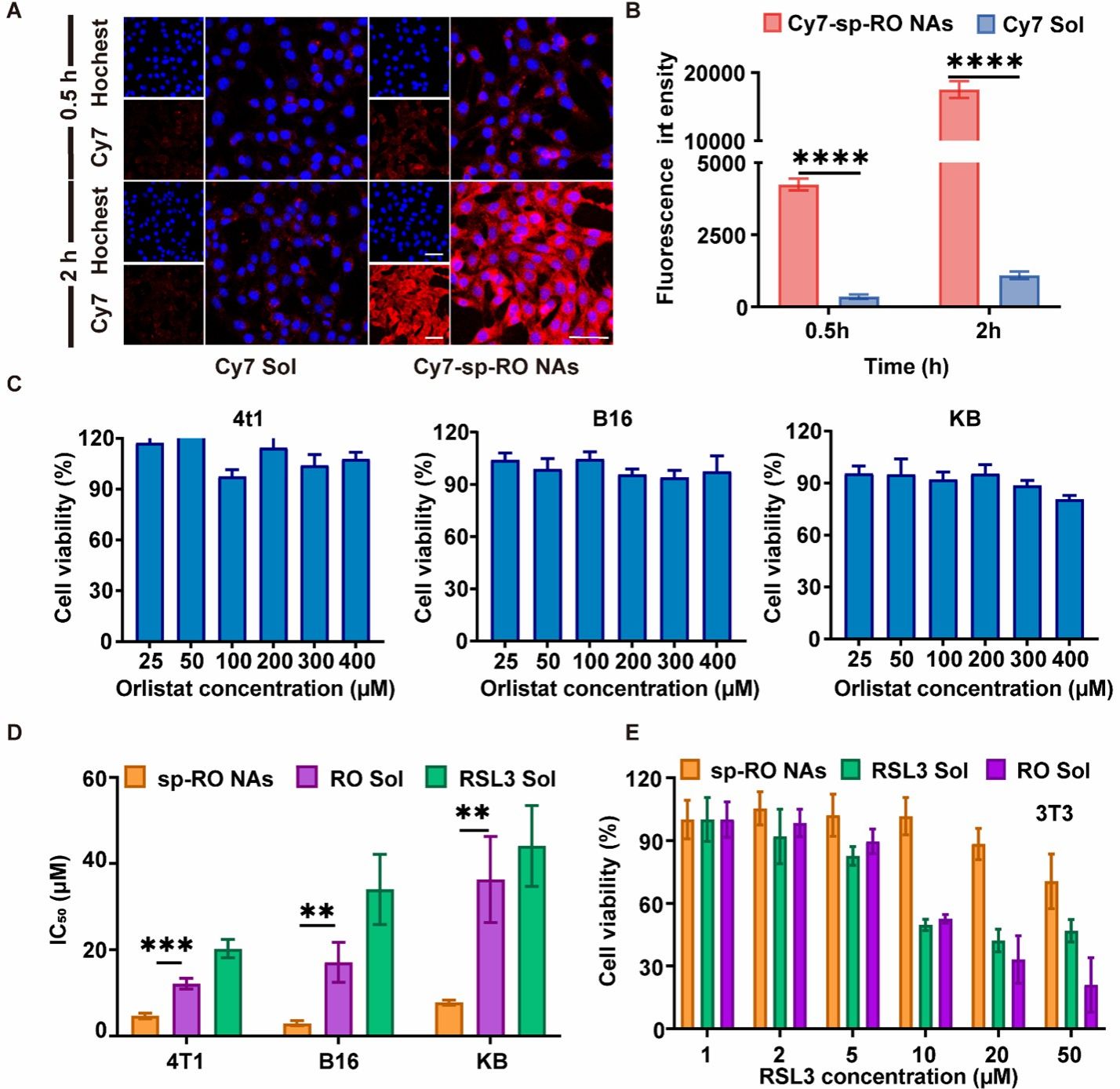
图3.脂质纳米调节器的细胞摄取及细胞毒性实验结果。
随后,作者通过使用铁死亡抑制剂Fer-1来证明铁死亡的发生。通过western blot实验验证了sp-RO NAs对GPX4和FASN表达的抑制,表明RSL3可以通过抑制GPX4破坏细胞内氧化还原稳态,导致细胞内ROS的积累,最终引发铁死亡。同时,Orlistat可以通过抑制FASN提高脂膜不饱和程度,从而提高细胞对ROS的敏感性。之后,作者检测了4T1细胞内氧化还原的水平,评估不同制剂诱导铁死亡的能力。结果显示经sp-RO NAs处理后的4T1细胞,胞内ROS、LPOs和MDA水平显著增高。这些结果证明,Orlistat确实能增强4T1细胞对RSL3诱导的铁死亡的敏感性(图4)。

图4.脂质纳米调节器的抗肿瘤机制。
接下来,作者考察了脂质纳米调节器的体内药动学行为。结果显示,脂质纳米调节器具有显著延长的血液循环时间,这有利于其在肿瘤部位的高效蓄积。随后,作者建立了4T1荷瘤小鼠模型,通过体内分布实验探究了脂质纳米调节器在小鼠体内的分布情况。结果表明,在相同条件下,Cy7-sp-RO NAs在肿瘤中显示的荧光信号比Cy7 Sol显著提高。离体荧光成像结果表明, Cy7-sp-RO NAs在注射后4 h的肿瘤积累效率均高于注射后1h的Cy7 Sol。这些结果表明,脂质纳米调节器可显著改善其药代动力学和肿瘤蓄积,从而提高抗肿瘤效果(图5)。
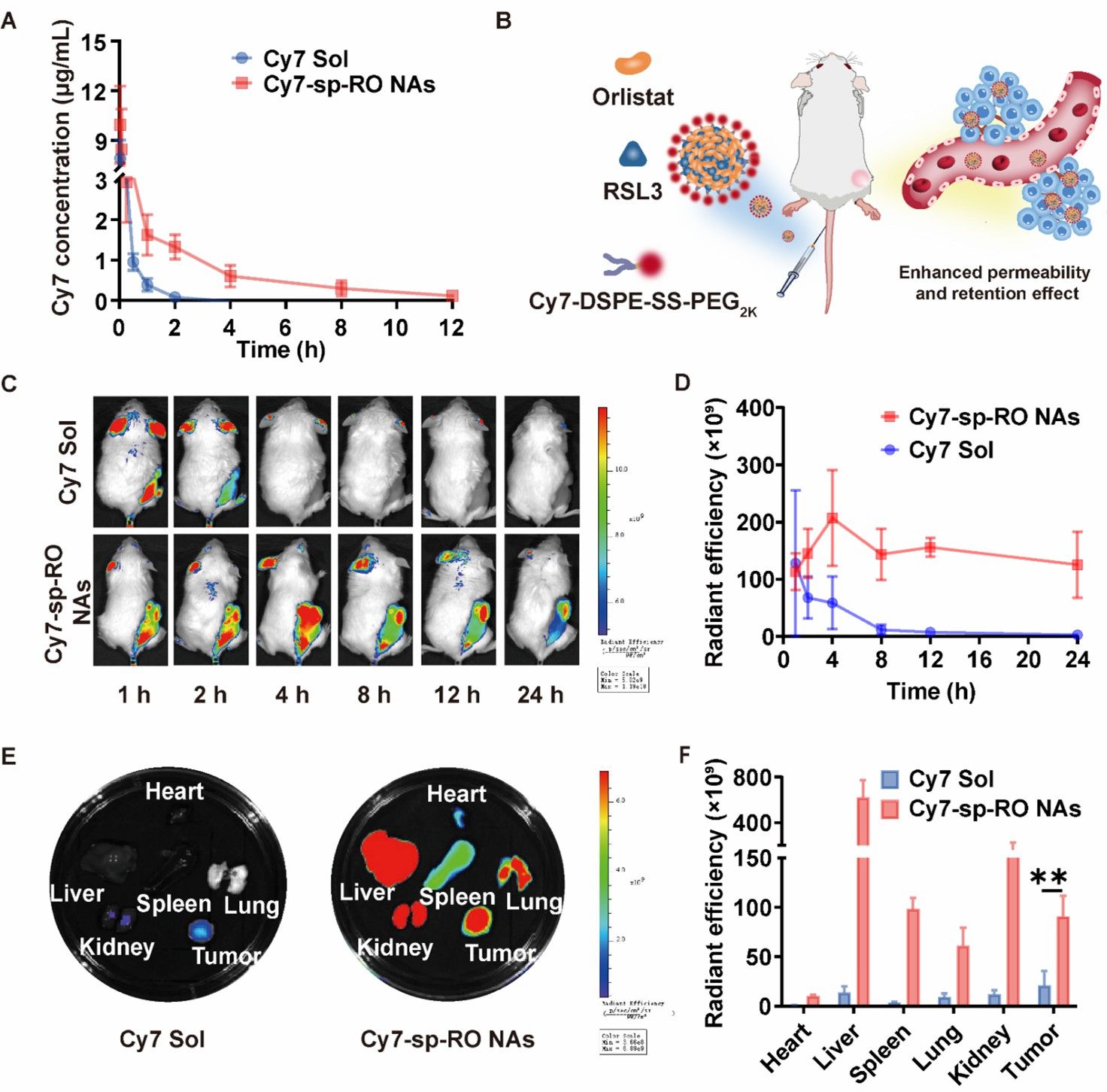
图5.脂质纳米调节器的体内药动学及体内分布实验。
最后,作者在4T1荷瘤小鼠模型中考察了脂质纳米调节器的抗肿瘤活性。结果表明,sp-RO NAs具有最强的抗肿瘤效果,并且体内机制实验进一步表明sp-RO NAs具较好的生成脂质过氧化物、抑制GPX4及FASN表达的能力。此外,作者进行了体内安全性的初步评价,发现脂质纳米调节器具有良好的体内安全性,小鼠体重与主要的组织器官均未观察到明显异常。综合来看,作者构建的脂质纳米调节器具有良好的肿瘤抑制效果,有望成为一种安全有效的药物递送系统,用于铁死亡驱动的癌症治疗(图6)。
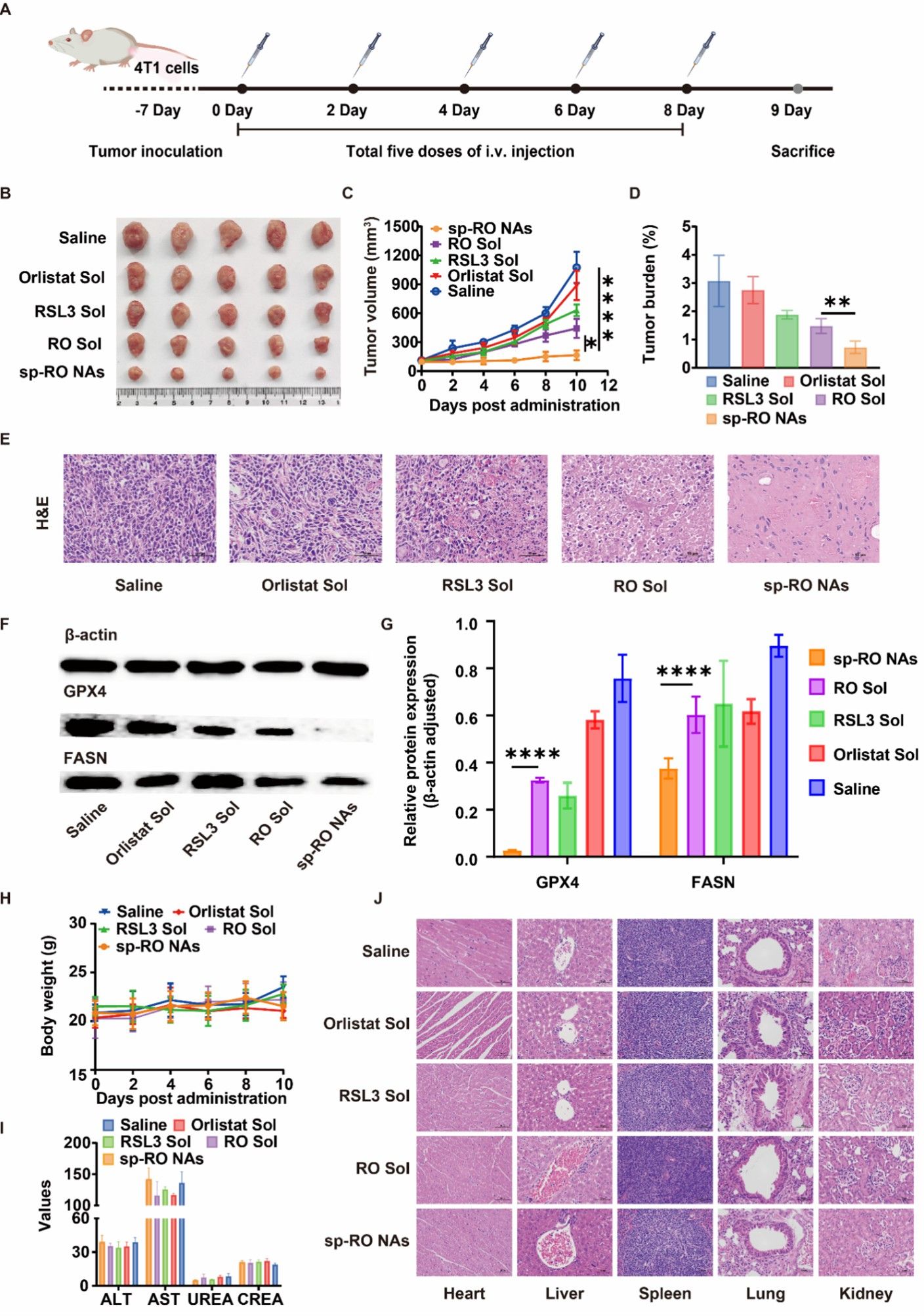
图6.脂质纳米调节器在4T1荷瘤小鼠中的抗肿瘤作用。
我院何仲贵教授和张申武教授为本文同通讯作者,2022级硕士生吴佳萍为第一作者,沈阳药科大学为第一通讯单位。原文链接:https://doi.org/10.1016/j.cej.2024.153366
辽宁省沈阳市沈河区文化路103号 | 邮编:110016
©2016 沈阳药科大学无涯创新学院 版权所有